皆さん、毎回お世話になっております!今回は、ベンゼン:C6H6からクロロベンゼン:C6H5Clが、どの様な過程を経て生成されるのか?その仕組みについて順追って、各段階ごとに話を進めて行きたいと思います。
この化学反応において最重要とされるのは、「※ 正電荷と負電荷の関係!」です。別記事にも化学の根本的考え方は、正(+)と負(-)の関係が最重要と記述致しました。この事は単純な考え方の様に思えますが、非常に重要視される所です!
ここでは再度、正(+)と負(-)の重要さを基本として考えて頂きますと、理解度が増して自然と記憶されて行くでしょう。それではスタート致しましょう!
1.ベンゼン:C6H6の構造!

有機化合物のベンゼン:C6H6の構造は6個の炭素原子:Cが同一平面上に存在しており、ベンゼン環として正六角形を構成する炭素原子:C同士の角度は全て120°になっています。またベンゼンの構造式は下記画像の様に「※ ケクレ構造!」と呼ばれる構造式と、これを省略した構造式の「※ ロビンソン構造!」であり、下記画像の様にイメージして頂くと理解しやすいと思います。
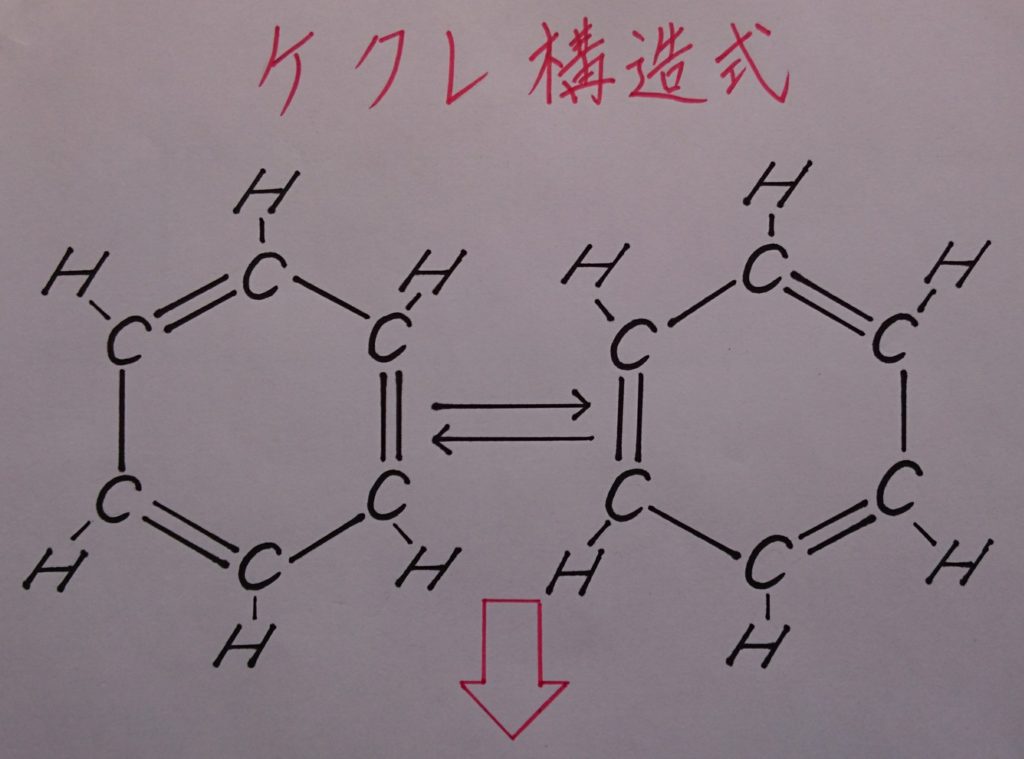
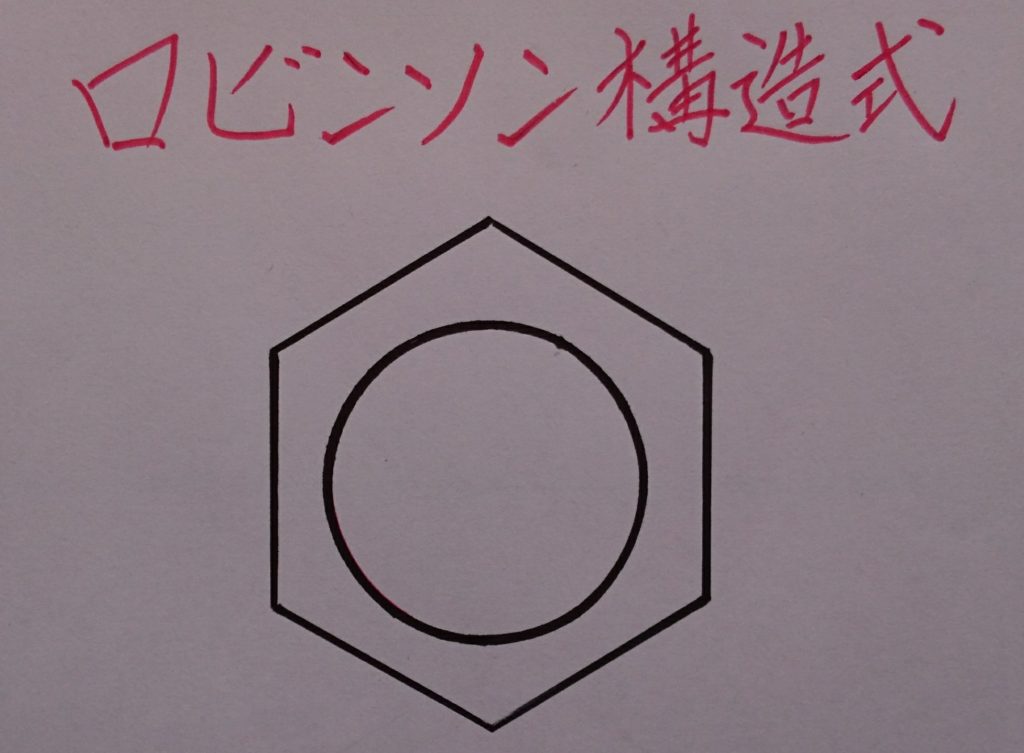
【※ ロビンソン構造式は、ベンゼン:C6H6が平衡状態にあると仮定した場合の中間的な構造式としてイメージすると理解しやすい!】
上記画像の左右2つのケクレ構造に着目して観ますと、炭素原子:Cと水素原子:Hは左右共に単結合を形成していますが、炭素原子:C同士の二重結合の位置は異なっています。ロビンソン構造式は、この2つのケクレ構造式を1つにまとめた構造式かつ中間的表記であり、実際こちらの方が正確な表記として扱われています。何故でしょうか?
それはベンゼン環内の6つの炭素原子:Cが、6つのsp2混成軌道を形成しているからです。1つの炭素原子:Cで考えると、「※ C-H間で1つのσ結合(=単結合)、C-C間で2つのσ結合(=単結合)、残った最後の1個の電子がπ電子であり、他の原子とは直接結合していません!」。
sp2混成内でσ結合を形成していない2pz軌道のπ電子は、平面状態のベンゼンC6H6を四方八方取り囲み、拡散し飛び回っているというイメージをされたらと思います。よって、常にベンゼンC6H6は負(-)に帯電している状態として存在している事になります(※ 負に帯電している状態にある事が最重要の着眼点であり、この状態を表した構造式としてはロビンソン構造式の方がイメージしやすいと思います!)。
この状態が「※ π電子雲であり、これが共鳴と呼ばれる電子の非局在可!」を表しています。
【✺ また、sp2混成軌道に付きましては別記事の、こちらを是非御覧頂けたらと思います!】
「※ 必見!酢酸CH3COOHの2s軌道が電子0個になる謎とは!?」
2.ベンゼン:C6H6の性質!
ベンゼンの構造を観ると六角形である事から固体の様にイメージ出来ますが、実際は液体として存在しています。よって水H2Oに溶けやすいイメージもありますが、ベンゼンは無極性分子であるアルカン(メタンCH4など)などの炭化水素と同様に極性を所有する水には溶けにくく、有機化合物に対しては互いによく溶け合う溶媒として使用されます(※ 無極性分子の炭化水素は、無極性分子であるベンゼンなどの有機溶媒に対してはよく溶けます!)。
ベンゼンの性質は、アルケンのエチレン:C2H4・アルキンのアセチレン:C2H2がπ電子により付加反応が起こりやすいのに対し、ベンゼン環としての構造自体が炭素原子:C同士のσ結合により非常に安定しているために、ベンゼン環内の水素原子:H等が他の原子・原子団に置き換わる「※ 置換反応!」が起こりやすいとされています。
この置換反応にはπ電子が大きく関わっているため、ベンゼン環は不飽和結合(※ まだ他の物質に変化出来る可能性がある結合!)であり、飽和結合(※ これ以上他の物質に変化出来ない結合!)ではない事にも着目しておきましょう(※ これ等の詳しい内容も見出し:1.で紹介致しました記事を御覧頂けたらと思います。)!
それではベンゼンの性質を生かして、ベンゼン:C6H6と、塩素:Cl2の置換反応に付いて考えて行きましょう!
3.ベンゼンC6H6と塩素Cl2の置換反応:ハロゲン化!
ベンゼン:C6H6と、塩素:Cl2の置換反応には触媒として鉄:Feか塩化鉄(Ⅲ):FeCl3を用います。ここでは触媒に塩化鉄(Ⅲ):FeCl3を用いて、水素:Hがハロゲン:Clに置換されるハロゲン化によってクロロベンゼン:C6H5Clが生成するまでの過程を大まかですが各段階的に考えて行きましょう。
[1.]まず塩素:Cl2と、鉄原子:Feより触媒の塩化鉄(Ⅲ):FeCl3が生成する化学反応式から始まります。
2Fe + 3Cl2 → 2FeCl3
[2.]次に、生成した塩化鉄(Ⅲ):FeCl3の空軌道(※ 鉄原子:Feは本来、3d軌道に非共有電子対(ローンペア)を1つ、不対電子4個を所有しており、電子の空席が4つ在ります!)に塩素Cl2のローンペアを配位結合させると、求電子剤(※ 電子が欲しい陽イオンあるいはラジカルにある状態!)である塩素陽イオン:Cl^+と、錯体のアニオン(※ 負に帯電した錯イオン)である、「※ テトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-」が生成されます!
Cl2 + FeCl3 → Cl^+ + 〔FeCl4〕^-
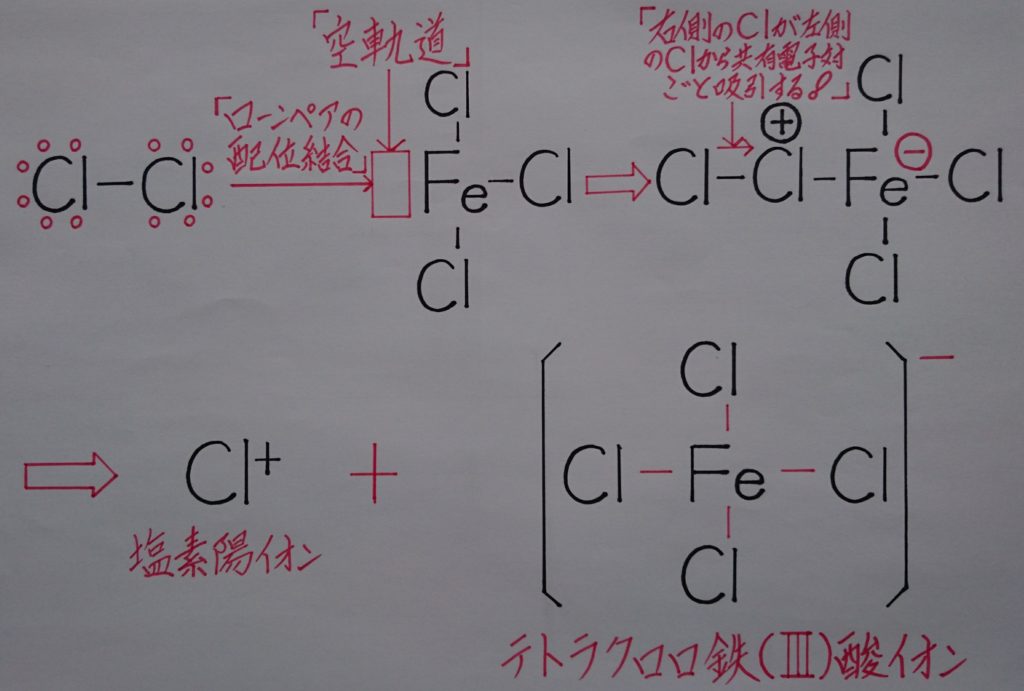
【※ 塩素:Cl2と、塩化鉄(Ⅲ):FeCl3の反応の仕組み!】
上記画像のイメージとして、塩素:Cl2の非共有電子対から電子1個を吸引している錯体:〔FeCl4〕^-が負(-)に帯電します。この時ローンペアの電子1個を失っている塩素:Cl2内に電荷の偏りが生じ、右側の塩素原子:Clが正(+)に帯電すると考えられます。
これにより正(+)に帯電した右側の塩素原子:Clが、同じ分子内の左側の塩素原子:Clから共有電子対ごと吸引し(※ 左側の塩素原子:Clから電子1個を完全に奪った状態!)、結果右側の塩素原子:Clはオクテット則(※ 最も安定した8電子による8電子則!)を満たす事になり、〔FeCl4〕^-が生成されます!
また同時に、「※ 電子1個を失った左側の塩素原子:Clの方は、ベンゼン:C6H6の2π電子を攻撃しやすい最もベストな状態の、正(+)に帯電する求電子剤となる塩素陽イオン:Cl^+として生成される!」事になります。
(Ⅰ):1つ目の可能性と致しましては、切断された2つの物質が全く同じであり、不対電子を所有する、Cl・(※ 塩素ラジカル)とCl・(※ 塩素ラジカル)が生じます!求電子剤がCl・(※ 塩素ラジカル)の場合には、π電子を1個だけしか吸引する事が出来ないため置換反応よりも、ベンゼン:C6H6に光(紫外線)を照射し、ヘキサクロロシクロヘキサン:C6H6Cl6が生成する「※ 付加反応に最も適した求電子剤!」となります。
つまり、3Cl2の6つの塩素ラジカル:Cl・としてベンゼン:C6H6の6つのπ電子とσ結合を形成する事によってC6H6Cl6が生成されます!
C6H6 + 3Cl2 → 光(紫外線)→ C6H6Cl6(ヘキサクロロシクロヘキサン)
(Ⅱ):2つ目の可能性と致しましては、切断された2つの物質が異なった、Cl^+(※ 塩素陽イオン)とCl^-(※ 塩化物イオン)が生じると考えられます。クロロベンゼン:C6H5Clを生成させる場合には、2つのπ電子を吸引可能なCl^+(※ 塩素陽イオン)が最も適した状態であり、かつ最も適した求電子剤となります!
塩素:Cl2が外部からの力を受けて切断されると、(Ⅰ)か(Ⅱ)の物質が生じる可能性が在ると考えられます。クロロベンゼン:C6H5Clを生成させる場合には、塩化鉄(Ⅲ):FeCl3に塩素:Cl2のローンペアを配位結合させる事により、(Ⅱ)のCl^+(※ 塩素陽イオン)とCl^-(※ 塩化物イオン)に切断させなければなりません!
これにより、「※ 切断されたCl^+(※ 塩素陽イオン)の方はベンゼン:C6H6の6π電子雲内の2π電子を攻撃する求電子剤となり、残ったCl^-(※ 塩化物イオン)は塩化鉄(Ⅲ):FeCl3に配位結合する事によって、錯体であるテトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-が生成される!」といった様な反応をイメージされますと、この後最終的にクロロベンゼン:C6H5Clが生成されるまでの一連の流れが理解しやすくなると思います!
再度ここまでをまとめますと、塩化鉄(Ⅲ):FeCl3に配位結合した塩素分子Cl2が、塩素陽イオン:Cl^+と塩化物イオン:Cl^-とに分散され、結果別れた塩化物イオン:Cl^-の方がFeCl3に配位結合した事により、負(-)の電荷を帯びた錯イオンのテトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-が生成がされます!
そして後に残った塩素陽イオン:Cl^+が、ベンゼン:C6H6の6π電子雲内の2π電子を攻撃する求電子剤として生成された事になります!
4.芳香族求電子置換反応!
求電子剤として生成した塩素陽イオン:Cl^+が、ベンゼン:C6H6の水素:Hと置換される反応を「※ 芳香族求電子置換反応!」と称しています。ここから塩素陽イオン:Cl^+が、いよいよベンゼン:C6H6と反応し始めます。クロロベンゼン:C6H5Clが生成されるまでをイメージしながら分析していきますが、生成されるまでの段階を、大まかですが大きく5段階に分けて理解していく事にしましょう。
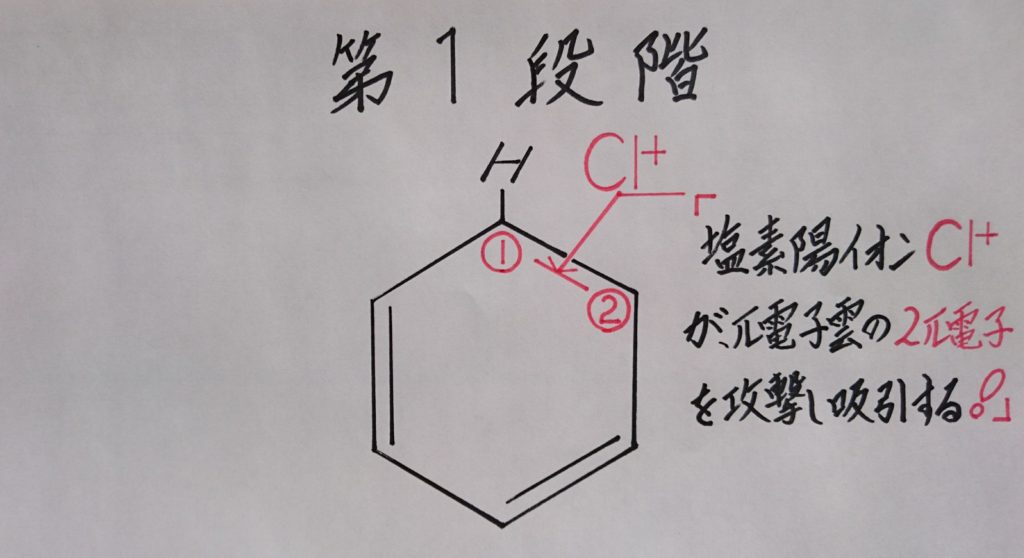
【※ ベンゼン:C6H6のπ電子雲と、塩素陽イオン:Cl^+の反応!】
第1段階では、まずベンゼン:C6H6を覆っている負(-)に帯電した6π電子雲に、生成した正(+)に帯電している塩素陽イオン:Cl^+が引き寄せられます。このCl^+が、上画像の(1)の「※ イプソ位(※ 上画像のベンゼン:C6H6の最上位に在る水素原子:Hが塩素原子:Clに置換され、最終的にクロロベンゼン:C6H5Clが生成された時の塩素原子:Clの位置がイプソ位である事を前提としています。)!」と(2)の「※ オルト位!」に存在する2π電子を攻撃吸引しにかかります!
〔※ 2π電子の動きが理解しやすい様に、あえてイプソ位とオルト位で表現しています。なお、置換基の位置の名称は本記事の最下部の見出し6.を御覧下さい!〕
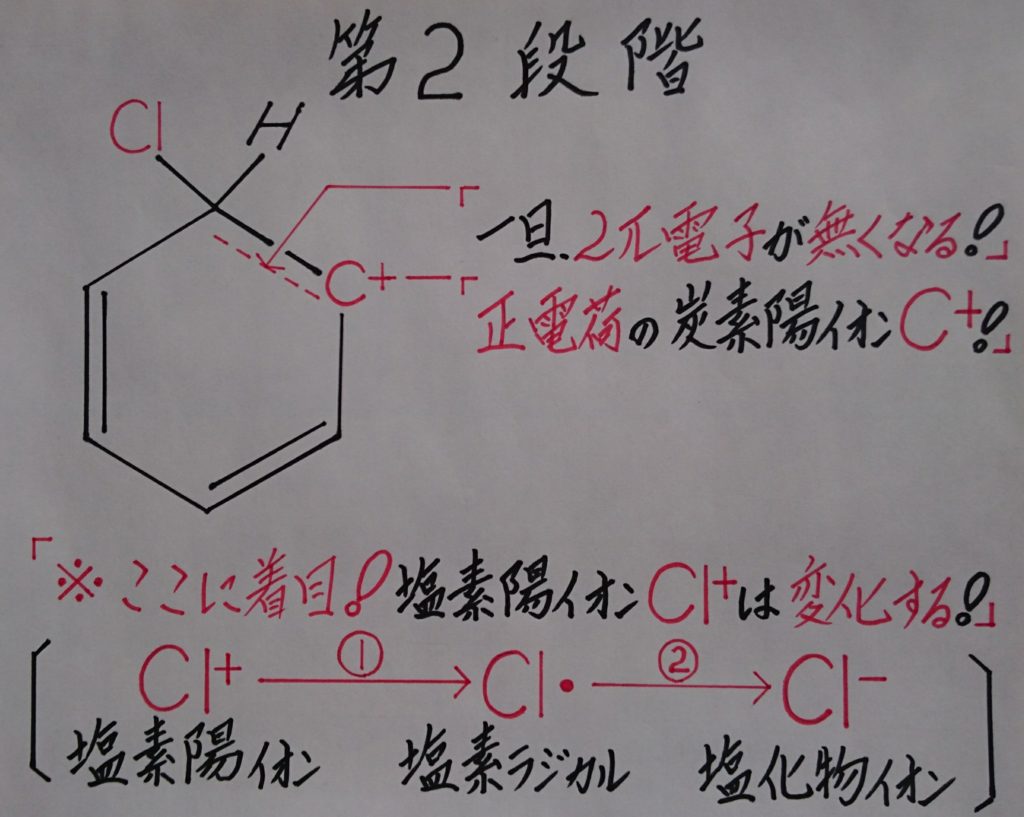
【※ 塩素陽イオン:Cl^+の変化!】
第2段階ではCl^+が最初にイプソ位に舞う1個目のπ電子を奪うと、直ぐ様オルト位に存在するπ電子を攻撃する事により、イプソ位に位置する炭素原子:Cとσ結合を形成し一旦中間的な構造が形成されます!
この状態は中間的な生成物として存在しているため、この後に記す表記(※ C6H6Cl^+)が適切な表記かは解りませんが、塩素陽イオン:Cl^+が2π電子を奪ったために、ベンゼン環内は正(+)に帯電していますので、言わばC6H6Cl^+が「※ 中間体として生成している状態!」、といった所でしょうか!
「※ 求電子剤である塩素陽イオン:Cl^+がベンゼン環内の6π電子の内の2π電子を攻撃し吸引するとCl^+は変化していく?この現象を次の様にイメージして考えていきますと、さらに理解度が深まると思います!」
(Ⅰ):求電子剤である塩素陽イオン:Cl^+が1個目のπ電子を奪い吸引すると、塩素ラジカル:Cl・に変化します!
【※ Cl^+ → 1個目のπ電子を奪い吸引する! → 塩素ラジカル:Cl・に変化する!】
(Ⅱ):次に、塩素陽イオン:Cl^+から変化した塩素ラジカル:Cl・が、2個目のπ電子を奪い吸引すると、塩化物イオン:Cl^-に変化します!
【※ Cl・ → 2個目のπ電子を奪い吸引する! → 塩化物イオン:Cl^-に変化する!】
(Ⅲ):以上をまとめると次の様に考える事が出来ます!
「※ Cl^+ → 1個目のπ電子を奪い吸引する! → 塩素ラジカル:Cl・に変化する! → 2個目のπ電子を奪い吸引する! → 塩化物イオン:Cl^-に変化する!」より、
【※ 塩素陽イオン:Cl^+ → 塩素ラジカル:Cl・ → 塩化物イオン:Cl^-(※ クロロベンゼン:C6H5Clの置換基Clがオクテット則(8電子則)を満たしている状態をCl^-としています!) 】
この様に求電子剤である塩素陽イオン:Cl^+が変化していく事を最重要視して頂いてイメージされますと、Cl^+が変化する度に2π電子によって還元されていく流れもイメージしやすくなり、理解度がアップするのではないでしょうか!
4-1.ベンゼン環内からの水素イオン:H^+(プロトン)の脱離!
第1段階では、塩素陽イオン:Cl^+が6π電子雲から2π電子を攻撃し吸引しました。この瞬間、オルト位の炭素原子:Cは1個のπ電子を奪われたため炭素陽イオン:C^+として正(+)の電荷に偏っていると考えられます!
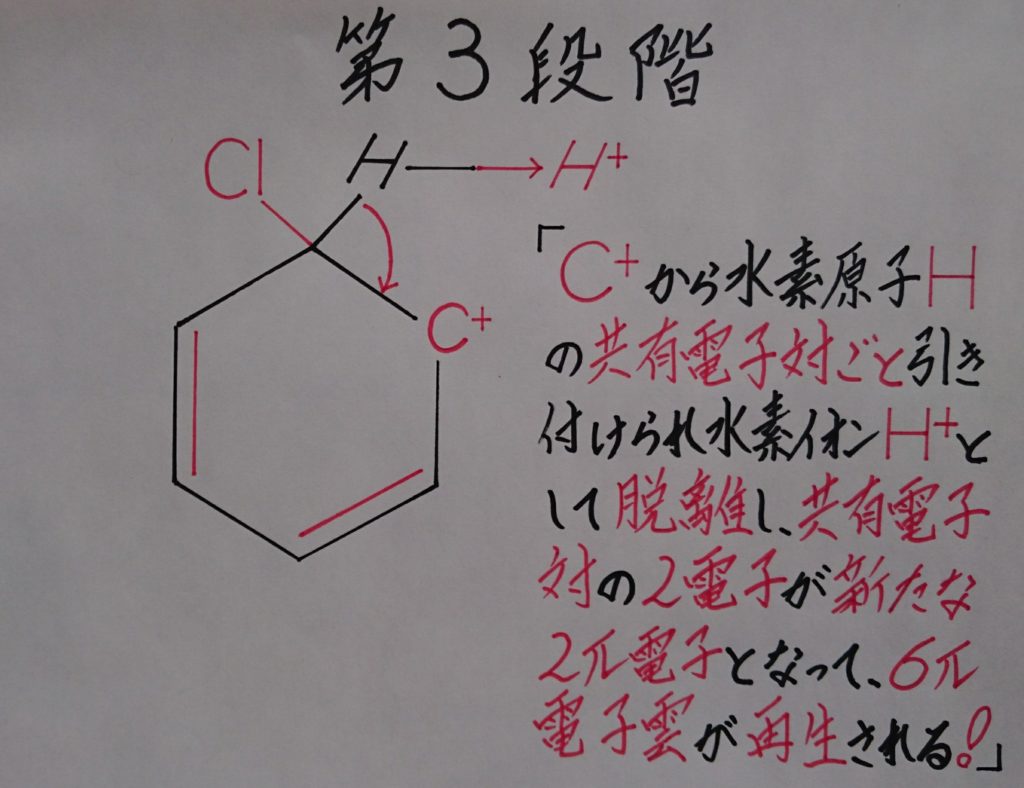
【※ 水素イオンH^+(プロトン)の脱離!】
第3段階での水素イオン:H^+が脱離するイメージと致しましては、この電荷の偏りによって炭素陽イオン:C^+がイプソ位の水素原子:Hに対し、共有電子対ごと吸引し共有電子対内の1個の電子を完全に吸引する事によってπ結合が再生され6π電子雲が復活します(※ 水素原子:Hより、電気陰性度の大きい炭素原子:CがHを引き付けるイメージ!)。
また、この段階での環内は正(+)に帯電している事から、水素原子:Hは水素イオン:H^+として環内の正電荷(+)と反発し合い、結果水素イオン:H^+が弾き出され脱離する、この様にイメージされますと理解しやすいのではないでしょうか!
4-2.クロロベンゼン:C6H5Clの生成と6π電子雲(π結合)の完全修復再生!
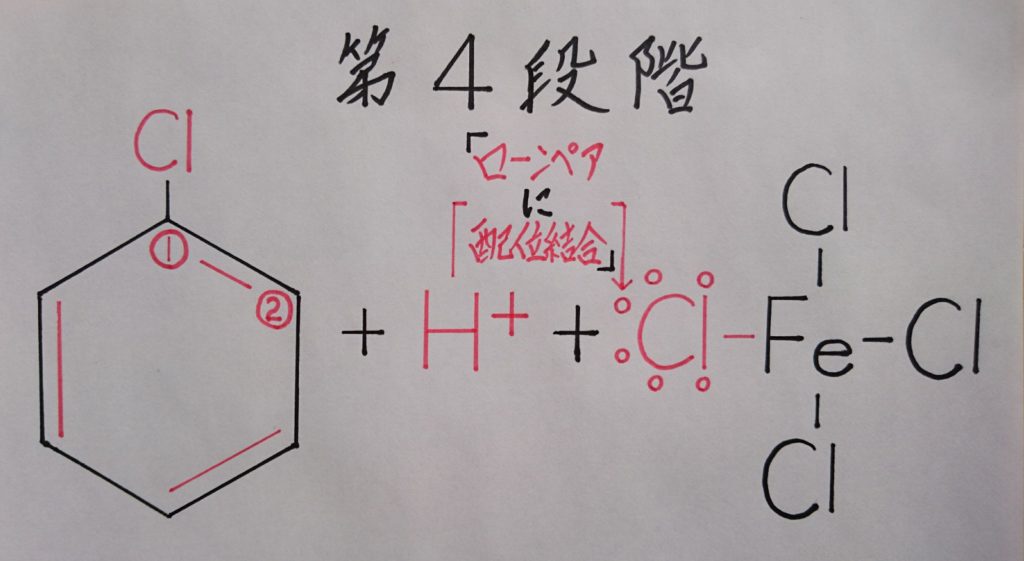
【※ クロロベンゼン:C6H5Clの生成!】
第4段階では、水素イオン:H^+の脱離によってクロロベンゼン:C6H5Clが生成されると同時に6π電子によるπ結合も再生されます。さらに脱離した水素イオン:H^+がテトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-内の塩素原子:Clの非共有電子対に配位結合します!
また塩素原子:Clに置換した事によって、置換したイプソ位で軌道自体もこの時点で炭素原子:Cを中心としたsp2混成軌道から、塩素原子:Clを中心としたsp3混成軌道(※ C-Clのσ結合、Clの所有する3つの非共有電子対を3つのσ結合と考慮した場合、合計4つのσ結合!)へと編成されたのではないかと考えられます。
一方、塩素原子:Clと結合している炭素原子:Cを中心として観た場合の軌道は、本来のsp2混成軌道に戻り、6π電子雲が修復再生され安定化する事になります!
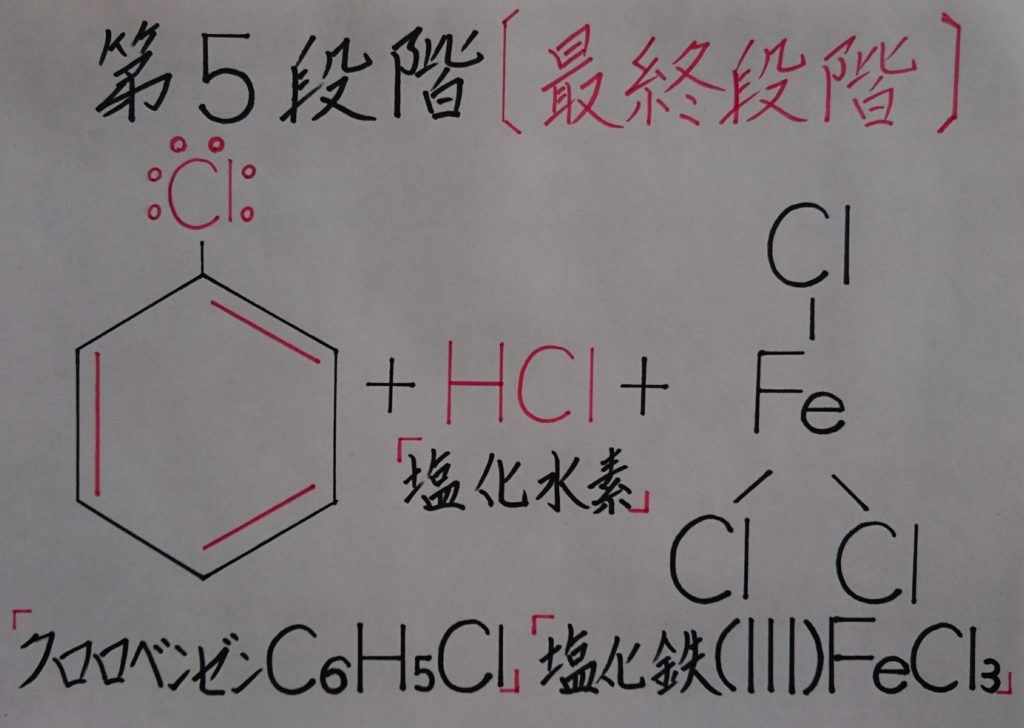
【※ 塩化水素:HClの生成と、触媒・塩化鉄(Ⅲ):FeCl3の再生復活!】
第5段階(※ 最終段階)では水素イオン:H^+が、テトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-内の塩素原子:Clの非共有電子対に配位結合した事で、塩化水素:HClが生成脱離し、テトラクロロ鉄(Ⅲ)酸イオン:〔FeCl4〕^-は触媒である元の塩化鉄(Ⅲ):FeCl3に還ります。結果、この事より塩化鉄(Ⅲ):FeCl3が触媒の役割を果たしていたのだと理解出来ます!
また画像中に記載しています、「※ + FeCl3」は、化学反応式には必要としませんが、理解度が深まるのではないかと記載致しました。実際には、次の反応式が最終的にクロロベンゼン:C6H5Clが生成され完結する化学反応式となりますので、御間違えの無い様にお願い致します!
【※ C6H6(ベンゼン) + Cl2(塩素) → (塩化鉄(Ⅲ):FeCl3・触媒) → C6H5Cl(クロロベンゼン) + HCl(塩化水素)】
これは、共有結合として生成した塩化水素:HClの方が、錯イオンかつ配位結合形成の〔FeCl4〕^-よりも安定した生成物であるがために、塩化水素:HClとして脱離する事を考えますと、改めて共有結合と配位結合の違いがイメージ的に理解出来るのではないでしょうか!」
【※ 再度繰り返しますが、第4段階で生成したクロロベンゼン:C6H5Clの6つの全ての軌道は6π電子も修復再生している事もあり、これより炭素原子:Cを中心に考えますと、ベンゼン:C6H6の6つの混成軌道と同じsp2混成軌道であると考えられます!
この事からも最終的には、ベンゼン:C6H6の水素原子:Hと、ハロゲン:Clとが置換反応により置き換わっただけでクロロベンゼン:C6H5Clが生成されるという仕組みが皆さん御理解出来たのではないでしょうか!】
5.ブロモベンゼン:C6H5Brの生成する仕組み!
ここでは、ベンゼン:C6H6と臭素:Br2の反応によってブロモベンゼン :C6H5Brが生成される仕組みも理解しておいて頂きたいと思います!
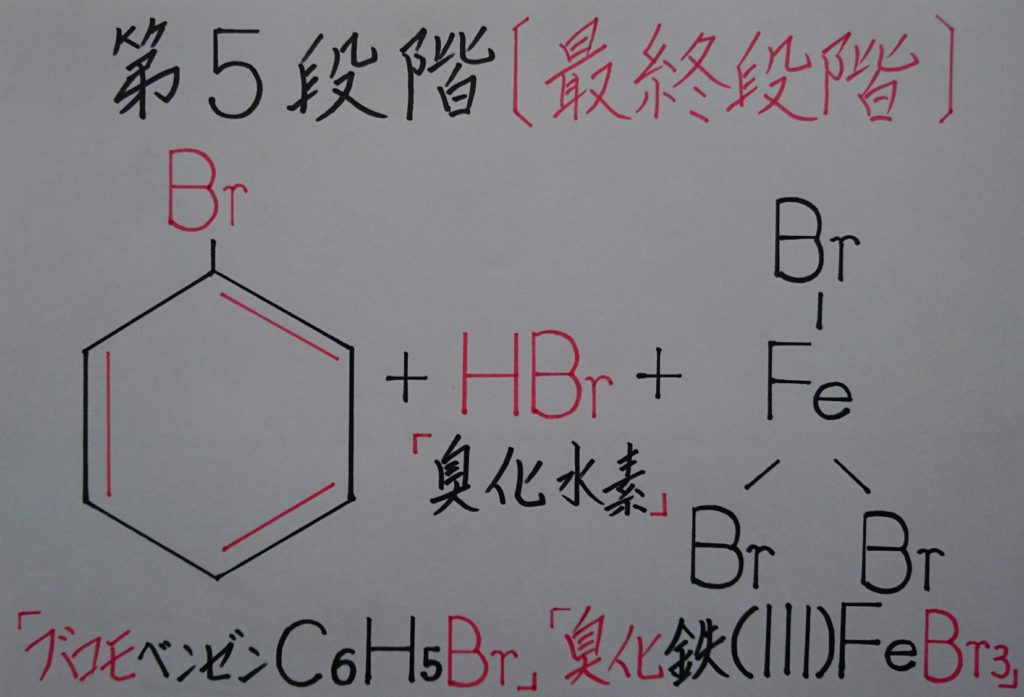
【※ 臭化水素︰HBrの生成と、触媒・臭化鉄(Ⅲ):FeBr3の再生!】
クロロベンゼン:C6H5Clと同様に、ブロモベンゼン:C6H5Brが生成される反応を次の様に簡単にまとめてみました。互いの反応の仕組みが1対のペアとして同時にインプットされておきますと、更に理解度が増すと思われます!
(Ⅰ):まず、臭素:Br2内の臭化物イオン:Br^-が触媒・臭化鉄(Ⅲ):FeBr3に配位結合して、錯体:テトラブロモ鉄(Ⅲ)酸イオン〔FeBr4〕^-が生成し、残った臭素陽イオン:Br^+が求電子剤となる!
(Ⅱ):求電子剤である臭素陽イオン:Br^+がベンゼン:C6H6の6π電子雲の2π電子を吸引し中間体が生成される!
(Ⅲ):中間体:炭素陽イオンが、ベンゼン環内のCーH間の共有電子対ごと吸引し水素イオン:H^+が放出され、「※ ブロモベンゼン:C6H5Br」が生成される!
(Ⅳ):放出された水素イオン:H^+が錯体内の臭化物イオン:Br^-に配位結合し、「※ 臭化水素:HBr」が生成され、錯体は本来の触媒・臭化鉄(Ⅲ):FeBr3に戻り反応終了となる!
大まかですが、(Ⅰ)~(Ⅳ)の様な反応を経て、ブロモベンゼン:C6H5Brと臭化水素:HBrが生成されます。
またクロロベンゼン:C6H5Clと同様に、画像中に「※ + FeBr3」と再生を意味する記載につきましては化学反応式には必要としませんが、理解度が深まるのではないかと思い記載致しました。実際には次の様な反応式になりますので、御間違えの無い様にお願い致します!
【※ C6H6 + Br2(臭素) → (※ 臭化鉄(Ⅲ):FeBr3・触媒) → C6H5Br(ブロモベンゼン) + HBr(臭化水素)】
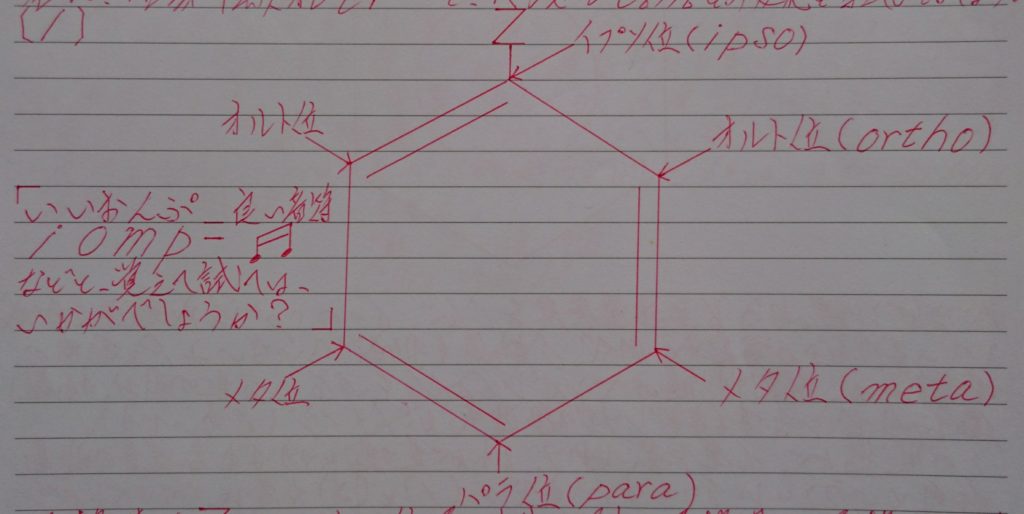
6.ベンゼン(C6H6)環に置換基が置換した位置(場所)の名称の覚え方!
最後に、ベンゼン(C6H6)環に外部から置換基(※ 最頂部の置換基を炭化水素基:-CH3・メチル基などを基準として考えています!)が置換した位置の名称についてですが(※ 下記の画像では最頂部の置換基を「Z」としています!)、
の名称が付いています!覚え方と致しましては、
などと覚えて試てはいかがでしょうか?
【✺ 併せて、こちらも是非御覧下さい!】
「上級名答!ベンゼンから、ニトロベンゼンが誕生する仕組み!」
「絶対太鼓判!ベンゼンからベンゼンスルホン酸が誕生する仕組み!」
「全集中フル回転!実はクメン法、凄い神技だらけの宝庫だった!」
今回は芳香族求電子置換反応によって、クロロベンゼン:C6H5Clと、ブロモベンゼン:C6H5Brが生成される仕組みについて段階的に観てイメージして頂きましたが、皆さん、この様に思われた方も多いのではないでしょうか?
「化学の基本は、やはり、正電荷(+)と負電荷(-)なんだな!」って。
私自身は常に、この様に大胆に思い切って考えて頂いた方が良いイメージが湧きやすく理解度が深まると思っています。これから先、有機化合物について皆さん各所に行き詰まる所が有るかも知れません。
ですが、有機化合物がある物質と反応する時、どこの電子に一番注目するかを予想して、それに関連する重要な電子1つ1つが、どこに移動して行くかをイメージして突き止めていきますと、どの様にして、ある物質として生成するかの一連の流れが理解出来ると思いますので、基本を忠実にこなして行って頂けたらと思います。
それでは今回もこの辺で、 See you !




















