今回も芳香族求電子置換反応の代表的なものとして、ベンゼンC6H6に脱水化したSO3H^+を反応させる、または三酸化硫黄SO3と反応させてベンゼンスルホン酸C6H5SO3Hが生成する仕組みについて話を進めて行こうかなと思います。
ベンゼンC6H6のスルホン化としてベンゼンスルホン酸C6H5SO3Hを生成させる為には2通りの方法が考えられますが、反応し合う仕組みと致しましては、ハロゲン化・ニトロ化とほぼ類似していますので、皆さん直ぐ理解される事でしょう。
ベンゼンのニトロ化と同様に、まずスルホン化に必要とされる知識を少々再確認しながら順に進んで行きましょう。
それでは、硫酸H2SO4から始動させましょう。
1.硫酸H2SO4内の結合はどうなっている!

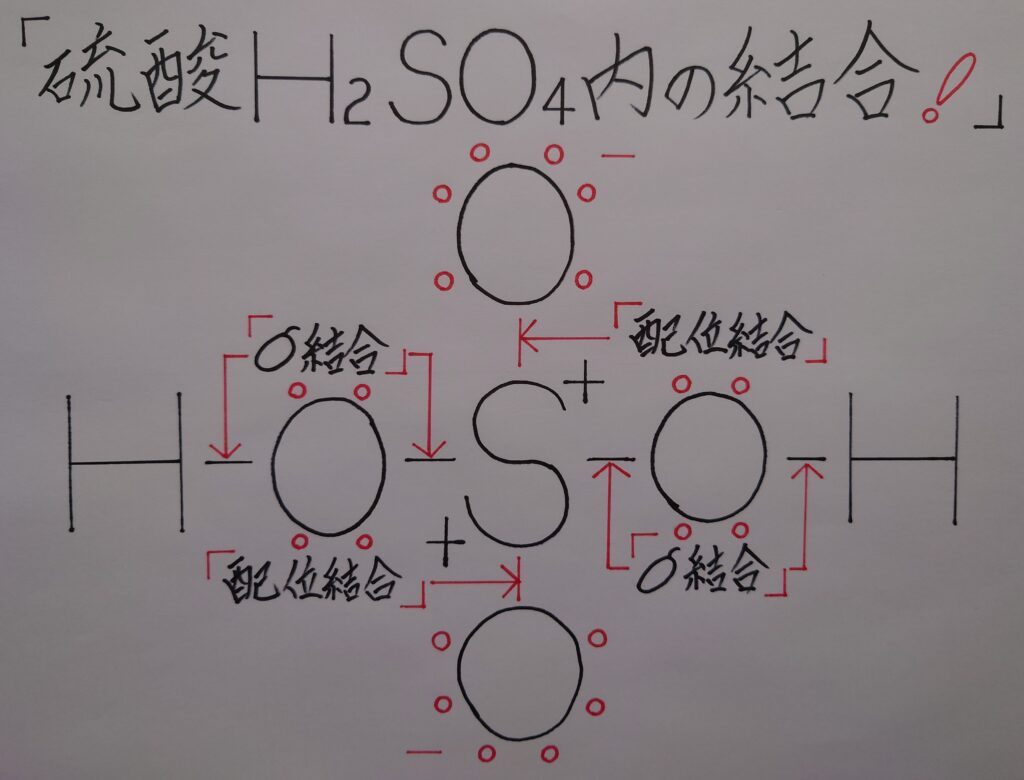
硫黄原子Sによる配位結合の場合、酸素原子Oの空軌道にローンペアが配位結合すると、1電子がO側に完全に引き寄せられる為に2つのOが負(−)に帯電し、逆にSが正(+)に帯電する事になります。
その為に通常より2つのヒドロキシ基(−OH)の酸素原子Oを引き付ける事により隣の水素原子HもOに引き寄せられ、水中では水素イオンH^+として電離しやすくなると考えられます。この様に硫酸分子の中で電荷の偏りが生じる為に、硫酸が強酸と呼ばれるのではないでしょうか(※ Sとσ結合を形成している2個の酸素原子Oは、2個の水素原子Hともσ結合を形成しO側に電子を引き付けています!)。
この様に硫酸分子内で電荷の偏りが生じているのですが、上画像でも解ります様に、硫酸H2SO4の硫黄原子Sはオクテット則(8電子則)を満たしており分子としては安定しています(※ 中には同じ硫黄原子Sでも、次に紹介致します❝三酸化硫黄SO3❞の様に、オクテット則を上回る場合が在ります!)。
皆さん硫酸の結合の場合、考え方自体は硝酸の結合と大して変わりませんので理解しやすかったのではないでしょうか(※ 別記事の硝酸HNO3内の結合でも述べました様に、配位結合と二重結合は類似していますが、全く別な結合ですので区別して御理解下さい!)。
2.超原子価化合物・三酸化硫黄SO3内の結合!

超原子価化合物の三酸化硫黄SO3の硫黄原子Sは第3周期に属しています(※ リンP等も超原子価化合物です!)が、この第3周期は3s軌道に始まり3p軌道、更に重要な3d軌道が存在する様になる為に複雑な混成軌道を取るのではないかと思われます。
2−1.三酸化硫黄SO3の電子配置が軌道に及ぼす影響を、「※ 2n^2」で考えイメージしてみる!
画像での結合の仕方を観る限り単純な構造として捉えがちですが、電子の配置を考えますと少々ややこしい構造になっている様です。まず、平面三角形構造の三酸化硫黄SO3は全て二重結合である為にσ結合とπ結合が絡んでいる事が予想出来、硫黄原子Sが3つの酸素原子Oと二重結合を形成している事から、全てのO原子とσ結合(単結合)とπ結合が成立している事になります。
この3つのσ結合からsp2混成軌道ではないかと仮定すると、当然コレにπ電子が加わる事になります。Sを中心として観ると、考え様によっては言わば3つのsp2混成軌道が存在する事になります。ですが、3s軌道と3p軌道には全部で8個の電子しか入る事が出来ません。
つまり炭素原子Cの場合と同様に考えますと、sp2混成軌道を形成した時点で3s軌道は完全に無くなる事になり、sp2混成軌道に既に6個の電子が使われており、あと3p軌道には2個の電子しか入る事が出来ない事になります(3s軌道の電子の数0個+sp2混成軌道の電子6個+3p軌道の電子の数2個=電子8個として考えて、硫黄原子Sの電子4個と、結合相手の酸素原子Oの電子4個としています!)。
残った3p軌道の2個の電子はπ結合による2π電子に使われると仮定すると、とりあえず3s軌道〜sp2混成軌道〜3p軌道までの電子収容数8個が成立します。最後に3p軌道に残った電子2個は3p軌道には収容されず、ここで酸素原子Oの2個の電子と、残った2個の電子がπ結合として合計4個のπ電子となって3d軌道に収容される事になります。
ここで本来空軌道である硫黄原子Sの3d軌道は存在しないと思いがちですが、これを電子殻の最大収容電子数の求め方「※ 2n^2(nは原子核からの殻の順番数)!」から考えてみますと、M殻内に3d軌道が存在している事になります。この事から、硫黄原子SはM殻として3d軌道も所有している事が解ります。
長々と三酸化硫黄SO3に3d軌道が使われているか否かを記述致しましたが、皆さんに伝わったでしょうか?これが私のイメージする三酸化硫黄SO3の3d軌道を混じえた混成軌道のイメージです。
予想したイメージが正しいかは判りませんが、イメージしながらイメージ力を養う事は、とても重要な事だと思います。他の記事でも記述しました様に、仮に間違っていても間違いは必ず直ぐに修正出来るはずですから、皆さん大胆に思い切ってイメージしてみてはいかがでしょうか!
2−2.ここが大事!第3周期から陽子・中性子の増加に伴い、軌道の範囲・電子の数も増加する!
第3周期以降の軌道を考える場合、3s軌道・3p軌道・3d軌道とか考えるよりも、まずは、原子核の陽子・中性子が増加する事によって軌道の数も増加する、つまり、陽子の増加に伴ってより長い距離の電子を引き付ける事が可能となるという事です。
どういう事か硫黄原子Sで例えますと、硫黄原子Sは普通に考えますと、電子が16個しか無いので3p軌道までしか軌道は必要ないと考えるのが当たり前ですが、しかし実際には3d軌道まで範囲を占め混成軌道として電子が存在して居るのではないかと考えられます。
これを「※ 殻!」として考えますと、硫黄原子Sの電子はM殻として存在している、つまり3d軌道まで電子が存在可能となる事に気付かれると思います!
ですので、オクテット則ばかりに気を囚われオクテット則(8電子則)よりも電子が多くなる場合には「何故?」と考えずに、「※ M殻として存在する硫黄原子Sの場合、M殻は3d軌道迄が電子の存在範囲であり、かつ陽子・中性子が増加する事によって当然オクテット則が破壊され、軌道の数も増加する!」と、この様に殻として割り切って考えて頂きますと(※ 他の原子も同様に考えます!)、オクテット則が破壊される場合もある事が良く理解出来るのではないでしょうか!
3.ベンゼンスルホン酸C6H5SO3Hの生成(ベンゼンのスルホン化)迄には、2通りの過程が在る!
ベンゼンC6H6からベンゼンスルホン酸C6H5SO3Hが生成する、ベンゼンのスルホン化は2通り存在します。1つ目はベンゼンC6H6と、三酸化硫黄SO3を濃硫酸H2SO4に過剰に吸収させた発煙硫酸H2SO4とを反応させる、2つ目はベンゼンC6H6に濃硫酸H2SO4を加え加熱する、の2通りです。
考え方と致しましてベンゼンのスルホン化は、ハロゲン化・ニトロ化の考え方と同様と考えて頂いても何ら問題御座いません。ですので、まずはベンゼンと三酸化硫黄の反応から観て行きましょう!
「❋ 発煙硫酸とはSO3を濃硫酸に溶解させ、濃硫酸内の水分子H2Oに吸収させます。この時昇華する性質を持つSO3は、空気中の水分子と反応して、この様(さま)が煙の様に観える事から発煙硫酸と呼ばれています。この生成した発煙硫酸を、更に希硫酸で希釈すると濃硫酸H2SO4が生成します!」
3−1.三酸化硫黄SO3とベンゼンC6H6の反応によるベンゼンスルホン酸の生成!
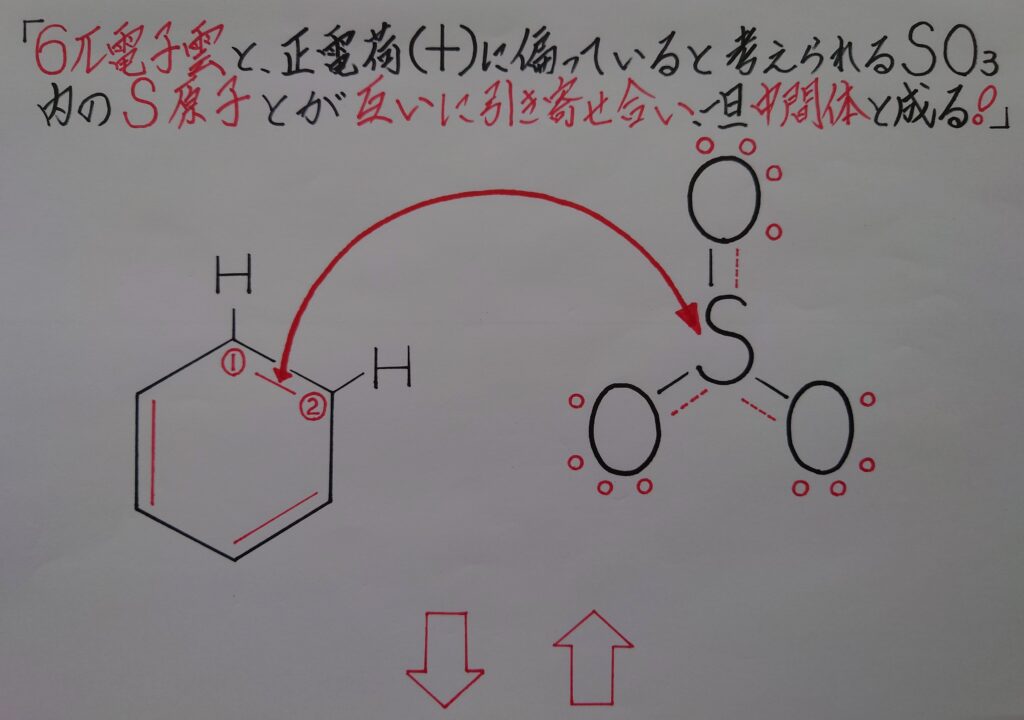
上画像はベンゼンC6H6の6π電子雲と、求電子剤(求電子試薬)である三酸化硫黄SO3とが互いに引き付け合っている図となっています。この状態は三酸化硫黄SO3のS原子が、3個のO原子に電気陰性度の差によって強く引き付けられている為に正電荷(+)に偏っており、ベンゼンの負(−)に帯電している6π電子雲と、三酸化硫黄SO3のS原子とが互いに引き寄せ合うと考えられます。
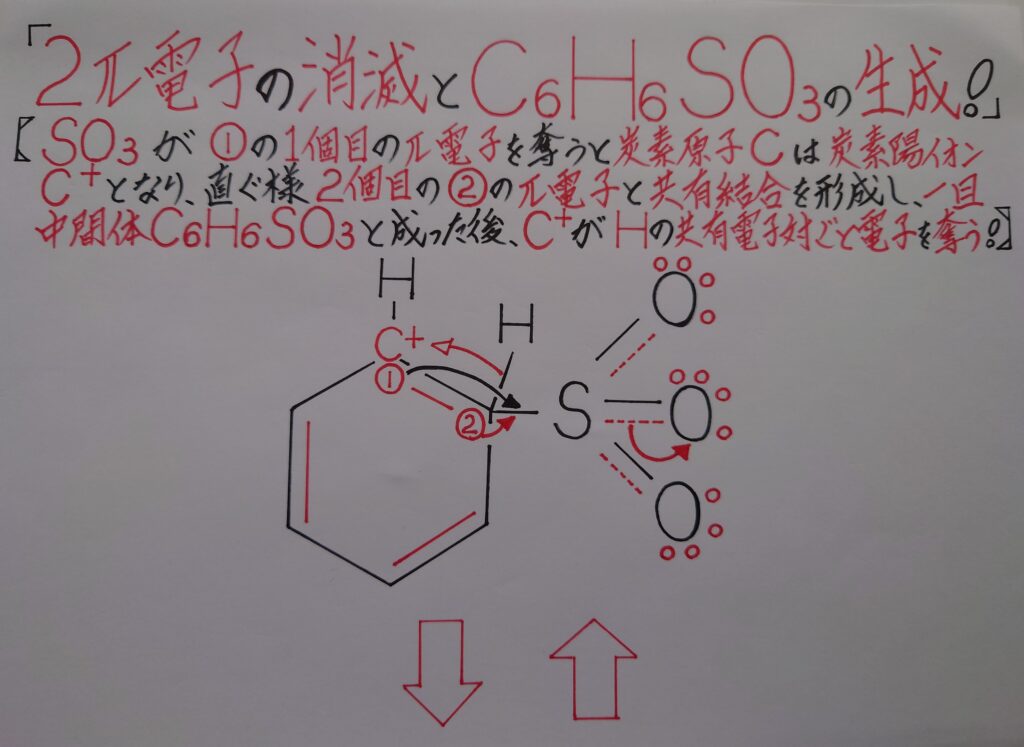
この後正電荷(+)に偏っているSO3は、まず画像中の6π電子雲である(1)の1π電子を奪うと、π電子を奪われたπ電子所有者である(1)の炭素原子Cは炭素陽イオンC^+になり、次いで(2)のπ電子とσ結合(単結合)を形成します。そしてこの瞬間、6π電子雲は破壊され2π電子が消滅し、一旦中間体C6H6SO3が生成する事になります。
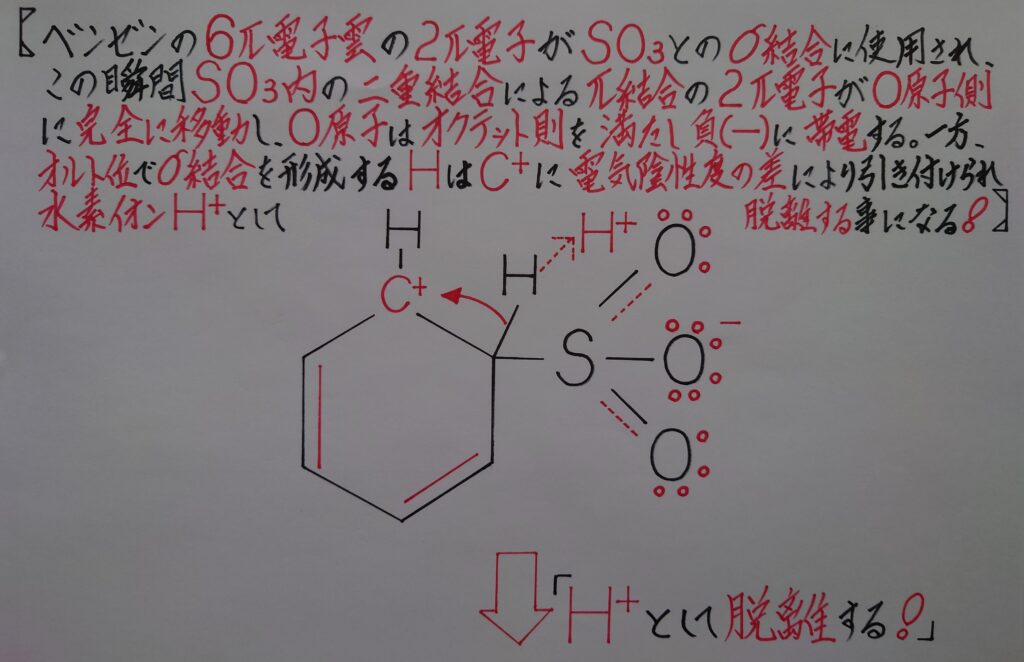
この時σ結合を形成したSO3内でS−O間での二重結合の内のπ結合の2π電子が完全に酸素原子O側に移動します。SO3はこの様に2π電子を移動させる事によって、σ結合で増加した電子分を帳消しにして酸素原子Oがオクテット則を満たすと共に負(−)に帯電し、一旦中間体C6H6SO3が形成されます。
同時に(2)の炭素原子Cとσ結合を形成しているオルト位の水素原子Hは、共有電子対ごと(1)の炭素陽イオンC^+に引き付けられ電気陰性度の差から電子1個を奪われ水素イオンH^+として弾かれる事になります。
また中間体C6H6SO3の記述に関しましては正しいか判りませんが、あえてC6H6SO3と記述させて頂きました。また電子の移動を示す矢印は皆さんが解りやすい様にと独自で判断し使用してあり、通常の矢印による電子の示し方とは異なる場合もありますので、以下同様に御了承下さい!
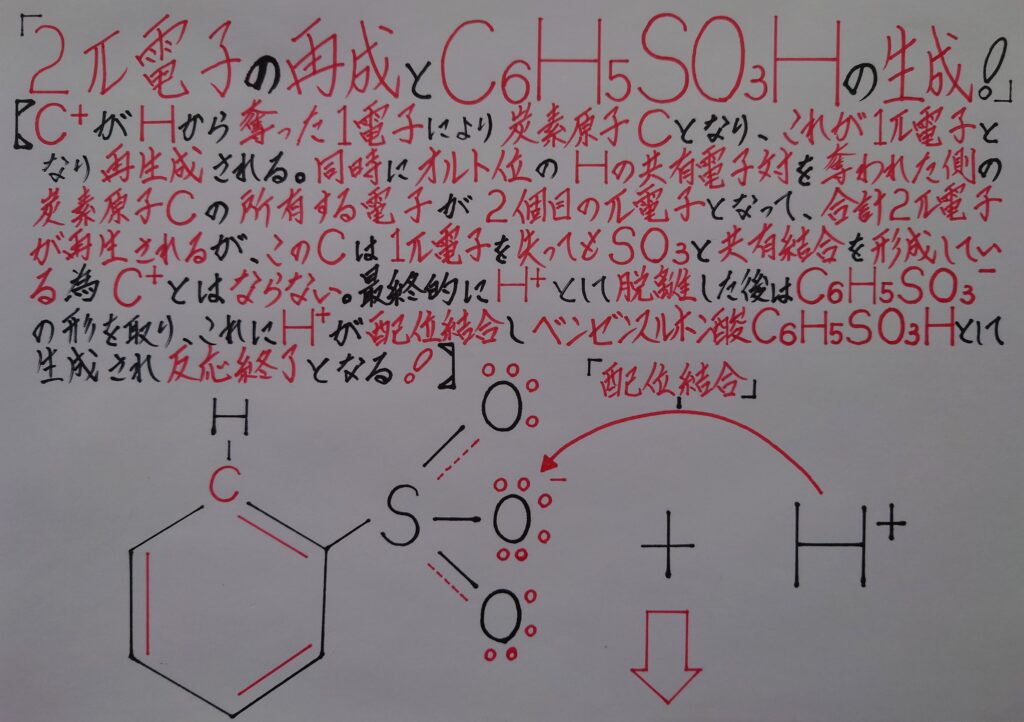
この段階では水素イオンH^+が脱離すると同時に6π電子雲が再生されC6H5SO3^-の状態として存在しています。因みに再生修復した2π電子の内1個目は炭素陽イオンC^+により奪われた水素原子Hの電子で、2個目は水素原子Hとσ結合を形成していた炭素原子Cが本来所有していた電子になります。
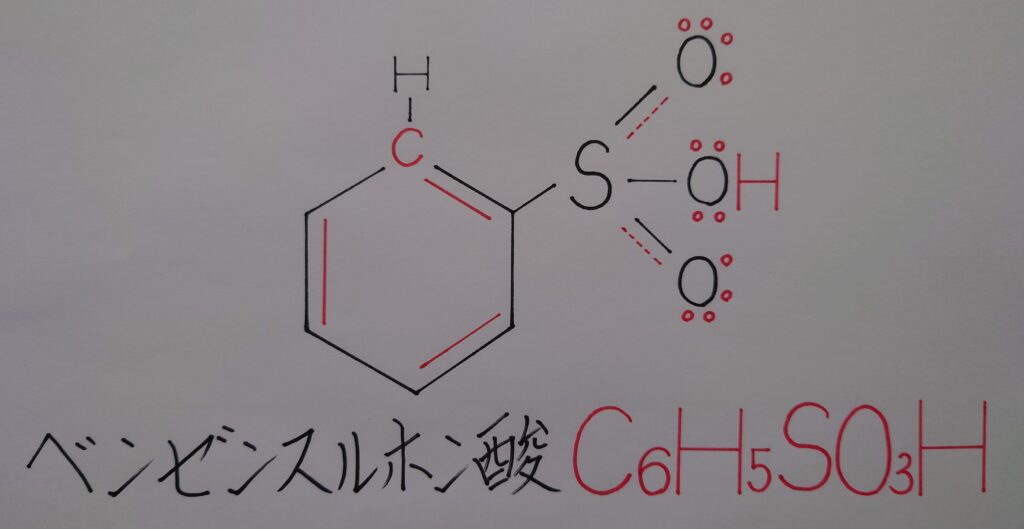
最終段階では脱離した水素イオンH^+がC6H5SO3^-内の酸素原子Oに配位結合してベンゼンスルホン酸C6H5SO3Hが生成され反応終了となります。
3−2.H3SO4^+(H2O−SO3H^+)から脱水化したSO3H^+と、ベンゼンC6H6の反応によるベンゼンスルホン酸の生成!!
濃硝酸HNO3と濃硫酸H2SO4の反応とは異なり、濃硫酸H2SO4の中にはH2SO4だけしか存在していない為にH2SO4同士で反応し合う事になります。濃硫酸H2SO4同士の反応は、
の平衡状態にあり、右方向に平衡が偏った時H3SO4^+(H2O−SO3H^+)から水分子H2Oが脱水化しSO3H^+が生成します(❋ 第1反応に硫酸H2SO4が両辺に在りますが、第2反応を生かす為に両辺と致しました!)。
また冒頭の硫酸の結合による構造から、硫酸H2SO4の放つ水素イオンH^+と硫酸H2SO4が反応し合うと、本来次の様に示す事が出来ます。

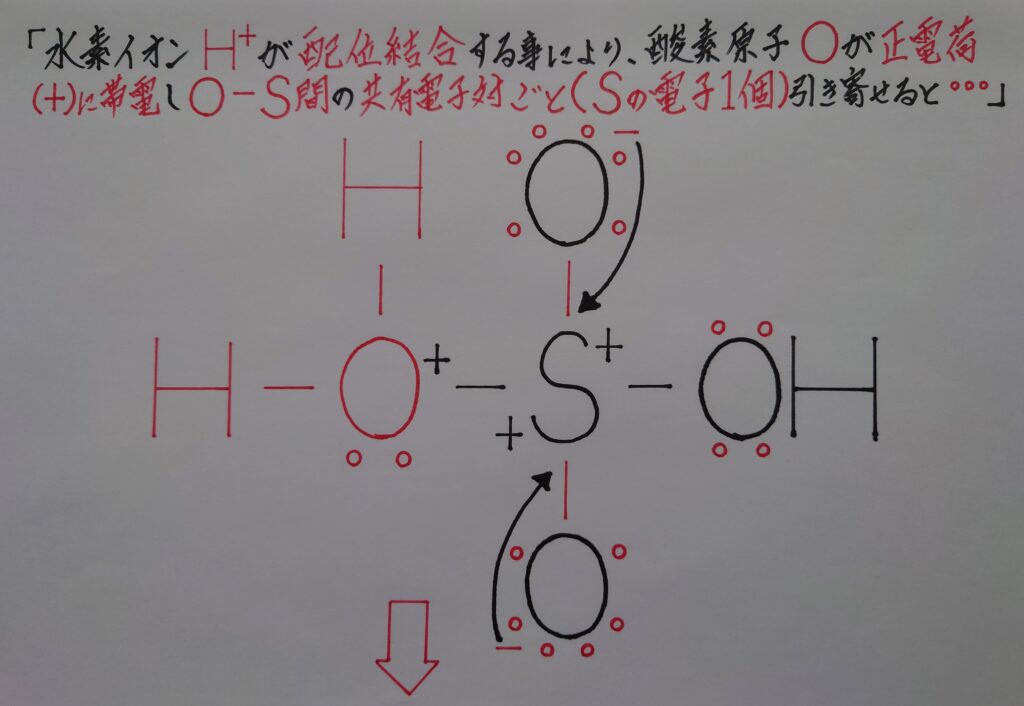
硫酸H2SO4の放つ水素イオンH^+がO原子に配位結合すると、O原子が対硫酸内のS原子から共有電子対ごと電子を奪い水H2Oが生成します。1電子を奪われたS原子は正(+)に帯電し、元々正(+)に偏っていた事もあり、2つの酸素原子Oから1個ずつ電子を引き寄せると…
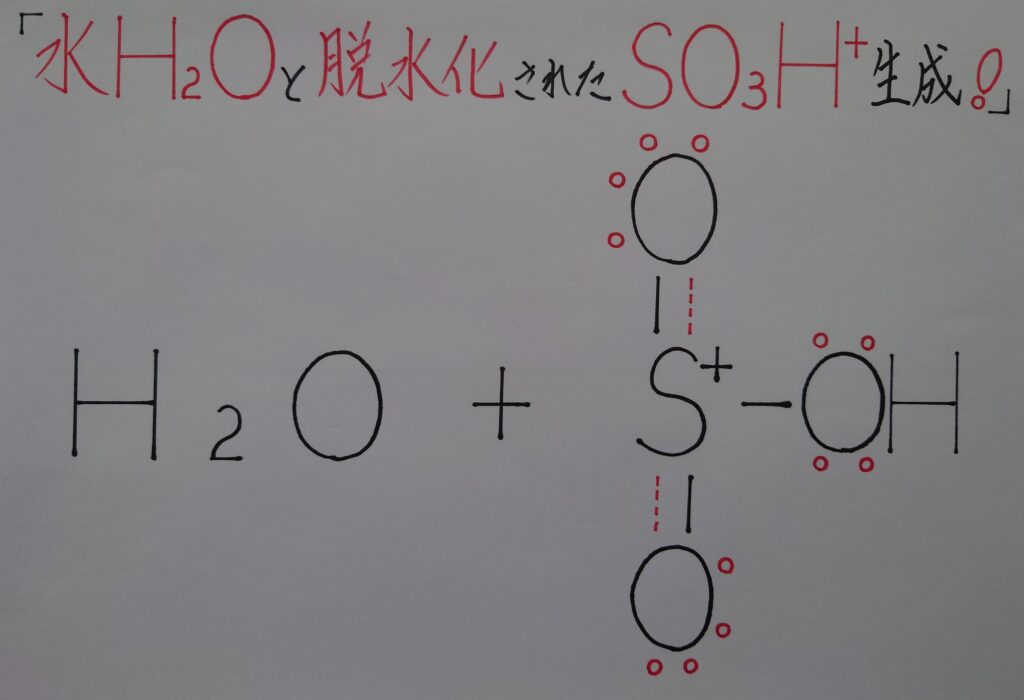
水H2Oと、脱水化し正(+)に帯電したSO3H^+が求電子剤として生成し、ここからベンゼンC6H6とSO3H^+を反応させていきます。またここでSO3H^+内の2つのS−O原子間の結合が、配位結合から二重結合に変化している事に着目して観て下さい!
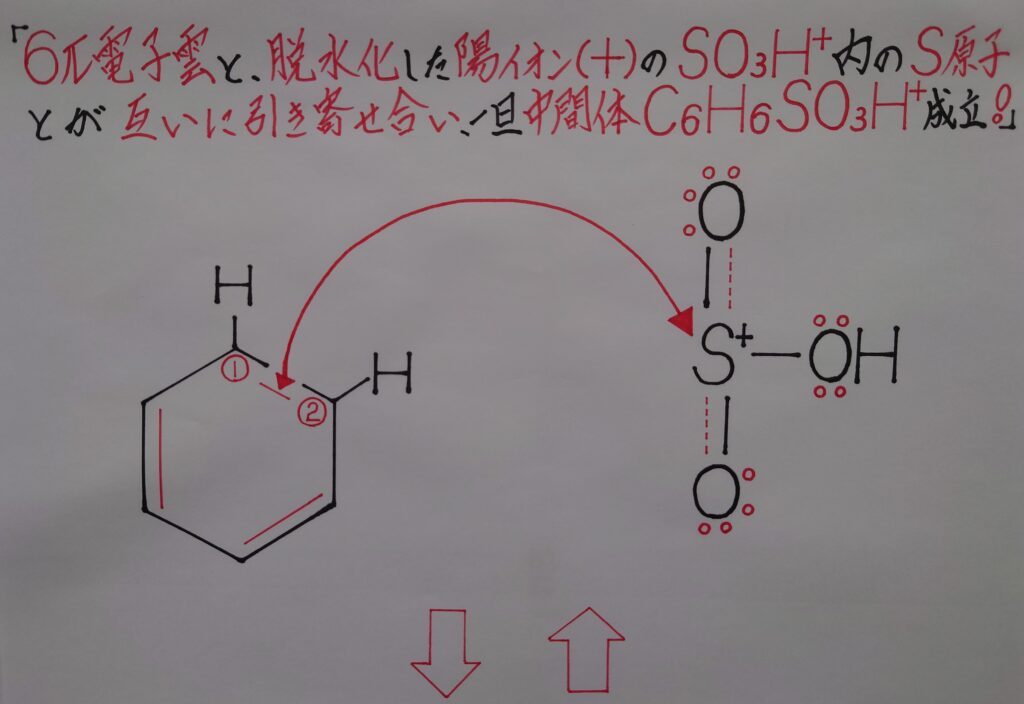
まず正電荷(+)に帯電しているSO3H^+と、ベンゼンC6H6内の負(−)に帯電している6π電子雲とが互いに引き寄せ合います!
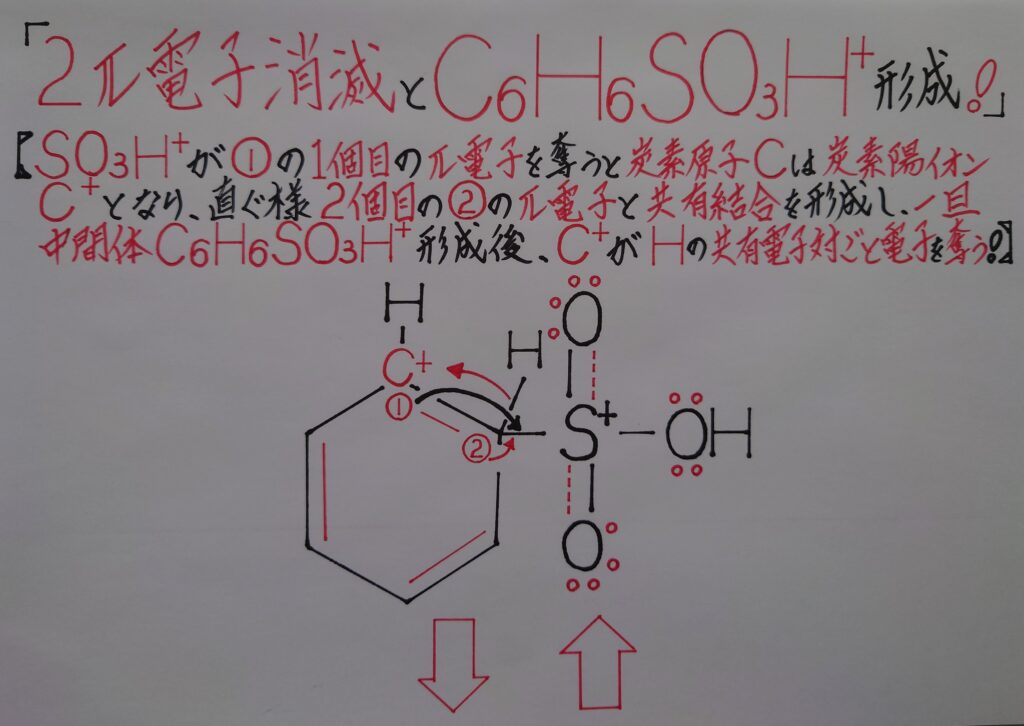
SO3H^+が6π電子雲の内の1π電子を奪い中和され中性のSO3Hとなり、逆にベンゼンC6H6が正(+)に帯電し、残りの1π電子とσ結合を形成する事から、ここで一旦中間体C6H6SO3H^+が形成されます!
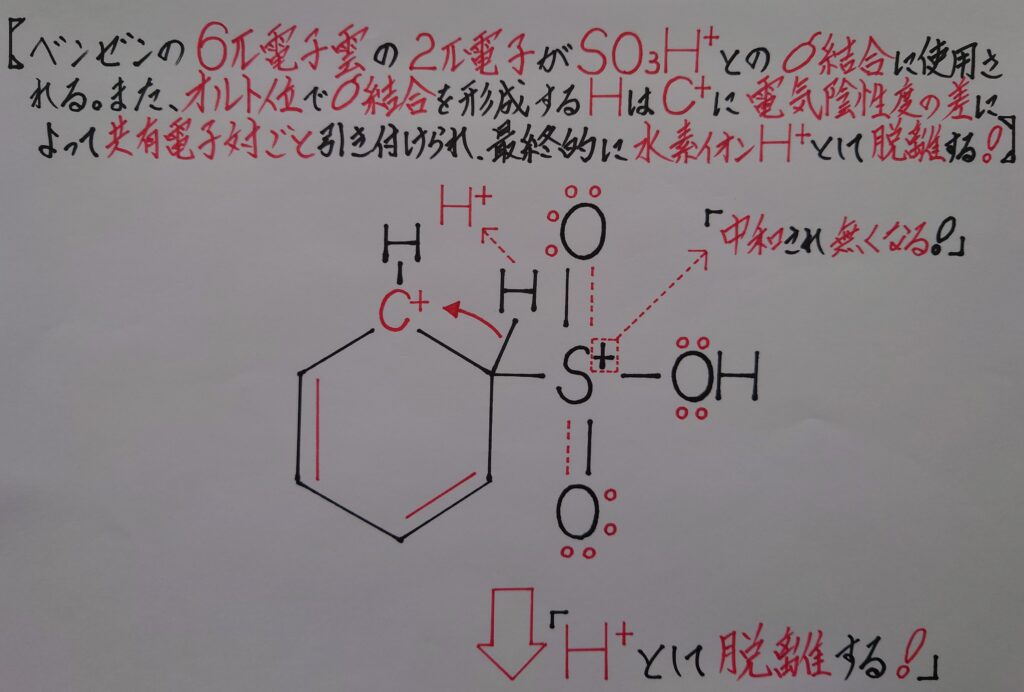
オルト位の水素原子Hが正電荷(+)の炭素陽イオンC^+から共有電子対ごと引き付けられ電子を奪われ、水素イオンH^+として脱離すると、
❝ベンゼンスルホン酸C6H5SO3H❞
が生成し、ベンゼン環内の6π電子雲も再生されます!
【✺ 6π電子雲には、混成軌道も付き物ですので、こちらの別記事も是非御覧下さい!】
「必見!酢酸CH3COOHの2s軌道が電子0個になる謎とは!?」

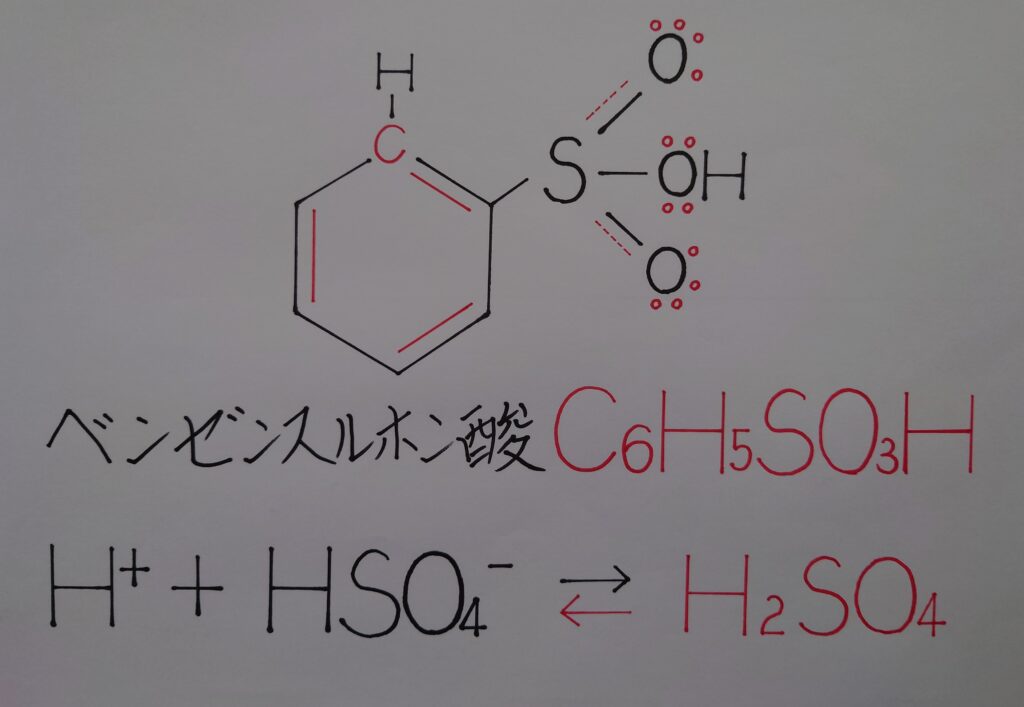
ベンゼン環から脱離した水素イオンH^+は、硫酸H2SO4から水素イオンH^+が放出された後の硫酸水素イオンHSO4^-のO原子に配位結合し、再びH2SO4を形成し上記の様な左方向へと大きく偏った平衡状態に入ります。これより最終的に、同じ硫酸H2SO4同士で元のH2SO4の形に還る事から、硫酸自体が触媒としての役目を果たしていたと考えられます!
以上が、スルホン化によるベンゼンスルホン酸C6H5SO3Hが生成する大まかな仕組みとなります。総合的に観た場合における着眼点と致しましては、求電子剤である三酸化硫黄SO3と、脱水化したSO3H^+の大きな違いが、SO3は中性的であり、SO3H^+は正(+)に帯電した求電子剤であると言った点にあります!
しかし、両者がベンゼンC6H6と反応し合った場合におけるベンゼンとの結合の仕方に付きましては、さほど変わりませんので皆さんなりのイメージでベンゼンスルホン酸C6H5SO3Hが生成する過程を理解頂けたらなと思います!
【✺ ベンゼンスルホン酸同様に、クロロベンゼン・ニトロベンゼン+クメン法も是非御覧下さい!】
「これぞ明解!ベンゼンからクロロベンゼンが誕生する仕組み!」
「全集中フル回転!実はクメン法、凄い神技だらけの宝庫だった!?」
4.化学反応式は、カッコいい&魅力が在る!
皆さん私の雑談なんですが、化学反応式には大きな魅力が在ると思いませんか?私は化学を何も知らない頃、偶々化学式を拝見する事になり、見ても当たり前ですが全く解らず、それでも無駄なあがきをして何回も覚えようとしましたが、全く覚える事さえ出来ませんでした。
自分の中では、(こんな自分カッコ悪いな!)と気付いた瞬間でもありましたから、こんな事もあり水素Hから勉強し始めました。水素Hの後は、いきなり応用編スタート・過マンガン酸カリウムKMnO4と過酸化水素H2O2の酸化還元反応に挑戦しました。ですが何度も「解った!」「やっぱり解ってない。」の繰り返しの連続でした。
この酸化還元反応をやっと理解出来たのが「❋ マンガンセブンプラス・Mn^7+じゃない?コイツが電子引っ張ってんじゃない?」、思い切ってこの様に考え始めた事をキッカケに化学反応式が少しずつ理解出来る様になりました。今でも自分なりにあみ出した「❋ 電子を引っ張るマンガンセブンプラス・Mn^7+!」は忘れずに鮮明にハッキリと覚えています。
ある時ある雑誌に化学反応式が記載してありました。(何かおかしい?)と思った私は雑誌の関係者に電話して「オゾンO3ではなく酸素O2ではないでしょうか?」と訪ねますと、ある有名大学の先生にまで話が行きまして、後日化学反応式に謝りがあったと電話がありました。この時、(自分、今ちょっとだけカッコいいんじゃない?)と、自分の中で思ったりもしました。
やっぱりコツコツやるって大事ですよね!今でも化学反応式自体と、化学反応式が解る人ってカッコいいと思っています(私はまだまだですが!)。皆さんは化学反応式ってどんな印象ありますか?私は結構カッコいいってイメージある人多いんじゃないかなって思っています。
皆さんには、本当に中味まで味のあるカッコいい大人になってもらいたいですので、これからもつまらない話かもしれませんが、少しでも参考にしてもらえます様に、機会がありましたらまた雑談聞いてもらえたら嬉しいです!
今回はスルホン化によるベンゼンスルホン酸C6H5SO3Hの生成について記述致しました。皆さん良く理解して頂けたと思います。次回もお役に立てる記事に挑戦して行きますので、宜しくお願い致します!ではこの辺で、また、 See you !




















