今回はタイトルに関連した、酢酸CHзCOOHは一体どの様な構造をしているのか、何故弱酸と呼ばれているのか等につきまして、まずは自由にイメージして頂こうかなと思います。今まで観えなかったものが少しずつ観えて来る様になると思いますので、是非思う存分イメージを働かせて下さい。
「前代未聞!?弱酸のpH&pOHを制覇する術(すべ)、此処に在り!」
の記事を御覧頂いて、知識として活用されたらと思います!
それではスタート致しましょう!
1.1価の酸:酢酸CHзCOOHとは?

別記事で紹介致しました「解の公式」と同様、酢酸CHзCOOHを1つとりましても、化学に関するありとあらゆる基礎がびっしり詰まっていますので、全部とはいきませんが、関係性のあるものを少しずつ観ていきましょう。
記事中に聞いた事のない名称等が出てきた場合には、「こういったのもあるんだ。」くらいのイメージでよろしいですのでお気軽にお付き合い下さい。また同じ意味でも、異なった名称として扱われている場合もありますので、こちらの方もインプットされたらと思います。
まず溶質(物質の三態:個体、液体、気体であり、ここでは酢酸の事)が溶媒(液体ですが、ここでは水の事)に溶解し(溶け込んで)、溶液(酢酸が水に均等に分散した酢酸水溶液の事)になります。
この電離した水素イオン:H^+に成りうるカルボキシ基:-COOH内の水素原子:Hを価数と呼び、水素原子:H1個=1価として、酢酸は1価の酸と呼ばれています。ですが、弱酸ですからあまりH^+(プロトン)を放出したがりません。この事を「酢酸は弱酸だから!」だと簡単に考えがちですが、皆さんには特にインプットしておいて頂きたい重要な事でもあります。
「※ つまりH^+が電離しても、陰イオンである酢酸イオン:CHзCOO^-として単独で安定化出来る!」という事です。当たり前の様ですけど、これが全ての理由だと言っても過言ではないと思いますので、インプットしておいて下さい!】
この事に付きましては、また後程詳しく触れていきたいと思います。
さて、一般に酢酸の様に、極僅かに水中で電離(水溶液中で、陽イオン[カチオン]:+と、陰イオン[アニオン]:-、とに分離する現象で、ここでは酢酸CHзCOOHが、陽イオン:H^+=水素イオンと、陰イオン:CHзCOO^-=酢酸イオンとに別れる事を指します)する物質を、(弱)電解質と呼んでいます。
因みに、分子式がC6H12O6の糖類である単糖類のグルコース(ブドウ糖)、フルクトース(果糖)、ガラクトース(脳糖)、分子式がC12H22O11の二糖類のスクロース(ショ糖)等は、非電解質と呼ばれ、電離しません。
つまり、陽イオン(+)と陰イオン(-)になる事が出来ないという事です!が、分子内にヒドロキシ基:-OHを所有しているので、水には良く溶ける性質(親水性)を持ち合わせており、水に良く溶けて水分子に囲まれている水和状態にあります。
これは炭素原子:Cが2つの酸素原子:Oとσ結合(単結合)し電気陰性度の差により2つのOが負(-)に、Cが正(+)の電荷に偏っている事と、2つのOの非共有電子対が関係している事が要因の1つだと思われます!
※ 唯一スクロースだけは、「-O-CH-OH-」を所有していないためにアルデヒドが生成されず還元性は示しません!】
「1.※ ケトン基:R-C(=O)-R′内の炭素原子:Cが正(+)に帯電(※ 電子を失った炭素陽イオン:C^+ではない事に注意する!)していると考えられる。重要なのはそのC(+)の隣に炭化水素基:C-Hが存在し、またアルデヒド基:-CHOが形成された隣にも炭化水素基:C-Hが存在している事である!
この事はC=C間に二重結合によるπ電子が存在する事と深い関連性があり、このπ電子を水素イオン:H^+が活用する事によって平衡状態が保たれていると考えても過言ではない!」
「2.R-CO-CH2OHの構造は分子中での平衡状態をとり、平衡時には外部からの原子またはイオンの影響は受けない!」
「3.平衡時には、ケトン基:R-C(=O)-R′とヒドロキシ基:-OHとが交互に生じ、また別なヒドロキシ基:-OHとアルデヒド基:-CHOとが交互に生じる!」
等が挙げられます!
また平衡状態にあるR-CO-CH2OHのケトン基:R-C(=O)-R′と、ヒドロキシ基:-OHが、-C-OHとして結合している炭素原子:Cはどちらも正(+)に帯電していると考えられるために、少々酢酸イオンCHзCOO^-の様な電子の移動による共鳴(※ 原子自体の移動はありません!)と似た様な反応が起こると考えられます。
よって、ここからフルクトース(果糖)を中心に考えて、平衡状態の中でどの様にして還元性のあるアルデヒド基:-CHOが生成されるのかをイメージして頂いて、酢酸イオンの共鳴と呼ばれるものと見比べてもらえたらと思います!】
1-1.フルクトース(果糖)の平衡状態におけるアルデヒド基:-CHO生成のイメージ!
[2]のヒドロキシ基:-OHの構造から、[3]のアルデヒド基:-CHOが生じる平衡は、[1]のケトン基:R-C(=O)-R′構造から[2]のヒドロキシ基:-OH構造が生じる反応と真逆的の様な関係にあると言えます!
また描き方が極端で解りづらいかもしれませんが、[1]と[2]、[2]と[3]の平衡状態を分けて考えて、電子の動きと、水素イオン:H^+がπ結合によるπ電子を利用し分子内を平衡移動するイメージとして大まかに書いて試ました。
最終的には[1]⇔[2]⇔[3]の平衡状態によってアルデヒド基:-CHOが生成し還元性を示します!】

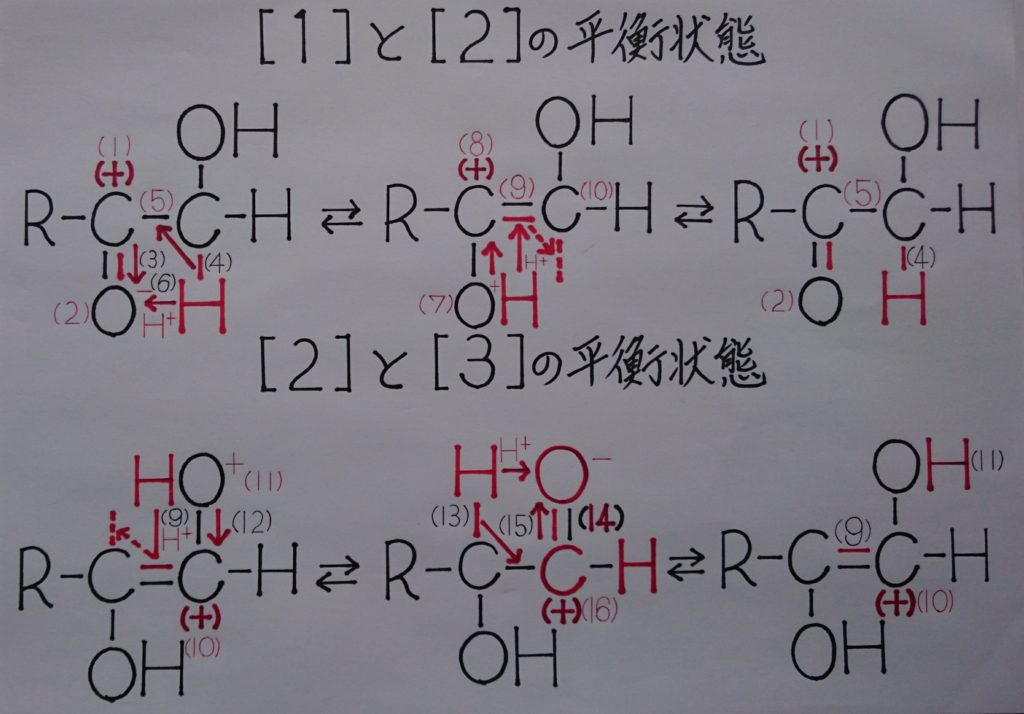
[2.](4)で共有結合を形成しているC-H間の2個の電子も、(1)のC(+)の影響によってC(+)の方に引き付けられ、σ結合(単結合)であった(5)のC-C間にπ結合が加わる中央上:[2]の(9)の二重結合C=Cを形成する。この時、2つのC原子がオクテット則(8電子則=自分の電子4個+相手の電子4個=8個の電子)を満たすため、C-Hの水素原子:Hが(6)の水素イオン:H^+として脱離する!
また実際には(1)のCの方は、二重結合により電子2個がオクテット則を上回っているため、(2)の二重結合内のπ電子1個が完全にO側に移動し、(3)のO^-として負(-)に帯電し、[2]の状態でオクテット則を満たす事になり、脱離した(6)のH^+がこれに配位結合し[2]の(7)のヒドロキシ基:-OHが形成される。まずこれらを左端上:[1]と中央上:[2]の平衡状態としてイメージして下さい!
[3.]次に中央上:[2]の(8)の炭素原子:Cは、(7)のヒドロキシ基:-OHのOから引き付けられ正(+)に帯電しているため、ヒドロキシ基:-OHのOの非共有電子対を1個引き付け再び右端上:[1]のケトン基:R-C(=O)-R′である二重結合を形成すると、正(+)に帯電するためこれと反発して水素原子:Hが水素イオン:H^+として弾かれる。このH^+が(9)の二重結合C=C間の1個のπ電子に配位し、再び(10)の炭素原子:Cと共有結合し右端上:[1]の(4)のC-Hを形成し元の構造[1]に戻り、今度は平衡が左方向の中央上:[2]へ移動し、後はそれぞれが繰り返しするイメージです!
[4.]もう1つの左端下:[2]から始まる平衡は、(11)のヒドロキシ基:-OHが(10)の炭素原子:Cを引き付け正(+)に帯電していると考えられ、C(+)がヒドロキシ基のOの非共有電子対(12)を引き付け二重結合を形成し、電子を引き付けられたOが正(+)に帯電しO(+)となり、これに反発して水素原子:Hが水素イオン:H^+として弾かれ脱離する。このH^+は(9)の二重結合C=C間のπ電子の1個に配位し、中央下:[3]の(13)のC-Hを形成する。この時[3]の(14)のアルデヒド基:-CHOが生成し還元性を示します!
[5.]中央下:[3]では、生成したアルデヒド基:-CHOのOに(16)のCが引き付けられているため正(+)に帯電し、これが(13)のC-Hの共有結合を引き付け再び二重結合であるπ結合を形成し、水素原子:Hは水素イオン:H^+として弾かれアルデヒド基:-CHOの二重結合内の(15)のπ電子に配位し元の右端下:[2]の(11)のヒドロキシ基:-OHに戻る!
また、このπ電子は(16)のC(+)が右端下:[2]の(9)の二重結合によってオクテット則を上回ったため、アルデヒド基:-CHOの二重結合内のπ電子1個がアルデヒド基:-CHOのO側に完全に移動し負(-)のO^-に帯電する原因となるπ電子(この時右端下:[2]の(11)、σ結合のヒドロキシ基:-OHに戻ります!)です。後は先程と同様にそれぞれが繰り返されるイメージです!
なお、単糖類に付きましては、
「似た者同士!グルコース、フルクトース、ガラクトースの平衡状態に迫る!」
の記事の方で、さらに詳しく紹介してありますので是非御覧下さい!
[2]:※ 銀鏡反応(銀(Ⅰ)イオンである2個のAg^+のそれぞれの電子の酸化数:+1がそれぞれ電子1個ずつを受け取り還元され、試験管内に銀:2Agが析出し銀鏡が生成する!) の2通りがあります。2つの水溶液はそれぞれ加熱し、さらに水酸化物イオン:OH^-が存在する塩基性の条件下にある事が必要となります! [1]:※ まず、フェーリング液の還元については、酒石酸イオン2分子が銅(Ⅱ)イオン:Cu2^+と錯イオンを形成するそうです。錯イオンを形成する事で、 2Cu2^+ + 4OH^- → 2Cu(OH)2 ↓ 銅(Ⅱ)イオンが青白色の水酸化銅(Ⅱ):Cu(OH)2として沈殿しない様に、またアルデヒド基:-CHOから電子を受け取りやすい様になる事で銅(Ⅱ)イオンが還元されるそうです! [2]:※ 銀鏡反応ではフェーリング液同様に、還元剤のアルデヒド基:-CHOや、酸化剤の銀(Ⅰ)イオンの半反応式が存在しますが(硝酸銀水溶液に過剰なアンモニアを加える事が重要になります)、銀鏡反応については次の様に考えると解りやすいのではないかと思い、自分なりの反応式を書いてみる事にしました。 [1.]2AgNOз + 2NHз + 2H2O → 2Ag^+ + 2OH^- + 2NH4NOз(2NHз + 2H2O ⇔ 2NH4^+ + 2OH^- より、なお生成した硝酸アンモニウム:NH4NOзは、完全に電離したイオンの形、NH4^+とNOз^-の状態にありますので、銀(Ⅰ)イオン:Ag^+の還元には影響ありません!) [2.]2Ag^+ + 2OH^- → 2Ag(OH)(一旦、不安定な水酸化銀(Ⅰ)が生成される!) [3.]2Ag(OH) → Ag2O↓ + H2O(すぐに褐色の酸化銀:Ag2Oが沈殿する!) [4.]Ag2O + 4NHз + H2O → 2〔Ag(NHз)2〕^+ + 2OH^-(アンモニアによって沈殿は溶けて、錯イオンのジアンミン銀(Ⅰ)水酸化物:2〔Ag(NHз)2〕OHが生成する!) [5.]R-CHO + 2〔Ag(NHз)2〕OH → R-COOH + 2Ag + 4NHз + H2O(加熱するとアルデヒド基:-CHOが酸化され、銀:Agに還元され析出し銀鏡が生成する!) この様に考えてみますと一連の流れが観えてくるのではないでしょうか?結局基本は正(+)と負(-)の反応であり、これに加え電子の移動が重要なんですね!これらの事を踏まえて再度酢酸について考えていきましょう! 酢酸がH^+をあまり放出しない原因に、電気陰性度(原子と原子とが互いに余っている電子=不対電子同士を引き付ける強さの度合いの数値の事で、余っている不対電子同士の結合を共有結合と呼びます)の差があります。 前述しましたが、酢酸が所有する水素原子:Hを、水素イオン:H^+として放出する部分は、官能基であるカルボキシ基:-COOHと呼ばれる中の、ヒドロキシ基:-OH(アルコール類の、-OHではありません!)の部分です。この:-OHから水素イオン:H^+が電離します。 このカルボキシ基:-COOHが水素イオンH^+を放出し(この時、水分子H2O内の酸素原子:Oが本来所有する電子2個が1対のペアの非共有電子対として2組あり、その内の1つのペアである非共有電子対によって正(+)に帯電したH^+と配位結合し引き付け、オキソニウムイオン:HзO^+が生成されます)、酸性という液性が決定されます。 仮に水分子がH^+を奪う事が出来ても、すぐに取り返され、また奪い返し、またすぐに取り返されるの繰り返し。だから中々電離出来ない!」といった様なイメージでしょうか。 「※ また酢酸を構成している炭化水素基(炭素原子:Cと水素原子:Hから構成されている原子団)と呼ばれるメチル基:CHз-の方の電気陰性度は、[炭素原子:C(2.5)>水素原子:H(2.1)]で炭素原子:Cが[0.4大きい!]ものの、極性分子(電気陰性度の大きい原子は僅かに負電荷δ-:デルタ・マイナスに、電気陰性度の小さい原子は僅かに正電荷δ+:デルタ・プラスに帯電した、共有結合に電荷の偏りがある分子の事)としては、電気陰性度の差が大き過ぎるという程ではないと言えます!」 因みに、塩化水素分子:HClは、「塩素原子:Cl(3.0)>水素原子:H(2.1)」と、塩素原子:Clの方が「0.9」と、CとHとの差「0.4」に比べ、互いの水素原子:Hとの電気陰性度の差はだいぶ大きい事が解ります。 この事より、酢酸の「メチル基:CHз-」は、炭素原子:Cと、水素原子:Hは電気陰性度にあまり差がないために互いを引き付ける力が強く(メチル基:CHз-は全てσ結合です)、水素イオン:H^+が電離しないと考えられます。一方の塩化水素分子:HClは、電気陰性度の差が「0.9」と大きいため、ほぼ水中で完全電離します。 ただし、これより電気陰性度の差がはるかに大きいフッ化水素:HFは、「1.9」程度、フッ化カルシウム:CaF2「3.0」程度等と電気陰性度の差は数値的に大きいのですが、水中ではあまり電離しません!この事から、 【※ もちろん電離するおおよその数値は重要ですが、電離する数値の範囲から、電離する・しないを判断する前に、「※ 結合している物質同士を良く観察して頂くと、ほどほどの電気陰性度の差がイメージとして段々と湧いてくる!」と思いますので、これによって電離するかしないかを心掛けて予想するのも良いかもしれませんね!これとっても大事!】 酢酸CHзCOOH内のメチル基:CHз-からは水素イオン:H^+は放出されない事が解りました!今度は、酢酸の構造なのですが、結構複雑な構造になっています。が、1つ1つ理解していけば大まかな構造がイメージ出来ますので、皆さん自由にイメージしてみましょう! 「2.二重結合であるカルボニル基:-C(=O)-内の1結合目の2原子間でのσ結合!」 「3.二重結合であるカルボニル基:-C(=O)-内の2結合目のπ(パイ)結合と呼ばれる原子核から離れた軌道(のイメージ)であり、原子核からのクーロン力(引力)の影響をさほど受けない電子である事から、π(パイ)電子と呼ばれる。 イメージとしては、既に負(-)に帯電しているσ結合が存在しているために、π電子がもう1対のσ結合を形成しようとすると、σ結合の電子と反発仕合い、結局反発が避けられる原子核から離れた軌道空間を分散し飛び回るしかないと言う様なイメージ。 俗にπ電子が非常に反応性に富む(=電子を奪われ易い)と言われるのは、原子核からのクーロン力の影響をさほど受けないために、電子を容易に奪われ易いためである!※ π電子は、後述する有機化合物の不飽和結合(二重結合、三重結合)に大きく関与している!」 「4.5.電子吸引基であるカルボニル基:-C(=O)-による二重結合のσ結合の電子と、π結合のπ電子を、電気陰性度の差によって、酸素原子:O側に強く引き付けている状態(=誘起効果)を表している。このために、Oは負(-)に帯電し、炭素原子:Cが正(+)に帯電している(負電荷の偏りが一方的にO原子に偏っており、これを分極と呼ぶ)。 この正(+)に帯電したCが酢酸の電離に大きく関与している!またカルボニル基:-C(=O)-のO原子の結合状態は、二重結合によるσ結合とπ結合、それにO原子が本来所有する☆2つの非共有電子対も共有結合としてみなされているためにsp2混成軌道となっている!」 「6. 4.と5.により、炭素原子:Cが正(+)に帯電している状態を表している!」 「7.酸素原子:Oは本来2つの非共有電子対(ローンペア)を所有しているため、このローンペアも混成軌道と呼ばれる軌道に参加しているとみなされている。酢酸分子CHзCOOH内には、酸素原子:Oが2つ存在するために、カルボニル基:-C(=O)-と、ヒドロキシ基:-OHの2箇所に、それぞれ2つずつのローンペアが存在して軌道を形成している事になる!」 電子殻に収容可能な電子数(=2n^2の計算式)により、それぞれ、K殻(n=1=☆1番目の電子殻より):2×1(=n)^2=2(個)、L殻(n=2=☆2番目の電子殻より):2×2(=n)^2=8(個)の電子が収容可能です。 これを電子の軌道として考慮すると、K殻に2個の電子を収容する球形の1s軌道、L殻には2個の電子を収容する同じく球形の2s軌道1つ & 6個の電子を収容する3つの8の字型(x、y、z軸の3つの軸が互いに直角に交差し、x、y軸を平面上に、z軸が垂直の3つ)の2p軌道が存在しています! 炭素原子:Cは1s軌道に2個の電子、2s軌道には価電子2個、平面上にある2p軌道の2px軌道に価電子1個と2py軌道に価電子1個、垂直である2pz軌道には電子0個の、合計電子4個(価電子)を所有しています! 「※ 共有結合出来る電子の数を原子価と言いますが、価電子の数とは意味が異なりますので再確認して下さい!Cは、価電子=4、原子価=4と同じですが、窒素:N等の様に、価電子=5、原子価=3(※ 不足分の2個の電子は、非共有電子対の数で、他の原子も非共有電子対を持つと電子の数が一致しない場合があります!)といった電子の数が異なる原子も存在しています!」 【〔2〕:まず、Cの2p軌道に結合電子(結合する原子の電子)が入って来ると、2s軌道の電子2個の内の1個が2p軌道の2pz軌道に昇位(移動)し、2s軌道には1個の電子が残ります!】 【〔3〕:次に、2p軌道の3つの軌道と、2s軌道に残っている電子1個がσ結合(単結合)する数によって、混成軌道の種類が決定します。この時σ結合した2s軌道と、同じくσ結合した2p軌道のいずれかの軌道が混じり合い軌道を編成しながら、2p軌道と2s軌道のエネルギーとの間に、新しいエネルギーの安定した混成軌道が生じます!これによって、2s軌道の電子は完全に0個となり無くなります!】 また、非共有電子対を所有している原子は、非共有電子対を原子間同士の結合とみなした場合(酢酸のC-OH等です)、混成軌道の形に似た軌道を形成する分子(sp3混成軌道の正四面体構造に近い、水:H2O、アンモニア:NH3等)も存在します!】 これらの事を考慮しながら炭素原子:Cを中心とした代表的な混成軌道である、[1]メタン分子:CH4、[2]エチレン分子:C2H4、[3]アセチレン分子:C2H2をイメージしていきましょう! メタン:CH4は、鎖状型(円形的環を形成しない)の鎖式☆飽和☆炭化水素でアルカンと呼ばれ、正四面体構造(※ 正三角形4つ。ピラミッド型の紅茶のティーバッグをイメージして下さい!)です! なおアルカンのメタン:CH4等は、ハロゲンである塩素:Cl2、臭素:Br2と共に、光を当てる事によって置換反応を起こす事が出来ます。置換反応の例としては、メタン:CH4の様な飽和化合物内の原子・原子団の※σ結合を破壊(C-H間のσ結合を破壊)して他の原子・原子団に置き換わり置換体となります。 例として、メタン:CH4と塩素:Cl2に光を当てると、水素:Hと塩素:Clが置換し置換体が生じ、置換体が生成する度に塩化水素:HClが生じます!】 メタン:CH4→(光:+Cl2/-HCl) →クロロメタン:CH3Cl→(光:+Cl2/-HCl) →ジクロロメタン:CH2Cl2→(光:+Cl2/-HCl) →トリクロロメタン(クロロホルム)CHCl3→(光:+Cl2/-HCl) →テトラクロロメタン(四塩化炭素):CCl4、まで置換されます。 【※ 結局、飽和状態のメタン:CH4にはπ結合による反応性の高いπ電子は無いので付加反応は起こりません!】 Cを中心に混成軌道を完成させるには、「※ Cの1s軌道は、3つの混成軌道を編成する場合に直接関与していないものとして、全ての混成軌道のCの1s軌道は考えない!」事にします。価電子4個を原子価として共有結合(σ結合)させる事から考えていきます。 sp3混成軌道を考える場合、L殻のCの2s軌道の電子2個と、2p軌道の2px軌道に電子1個、2py軌道に電子1個、2pz軌道には電子が無く0個!、合計4個の価電子が原子価として4つの水素原子とσ結合を形成し完成します。 この電子0個の2pz軌道が、2s軌道から電子1個を受け取り混成軌道に参加し、同じく2s軌道に残った電子1個も混成軌道に参加して、sp3混成軌道が形成されます! (Ⅰ):まず、相対する水素原子:Hの電子が2p軌道内に入って来ると、2s軌道の電子1個が2p軌道の2pz軌道に昇位(=励起=電子が飛び移る事)し、2pz軌道に電子1個が生じます。これで2s軌道と、2p軌道:2px・2py・2pz軌道の3つ全てに電子が存在している事になって、炭素原子:Cと、4個の水素原子:Hとσ結合を形成する事が出来ます。ですが、このままでは軌道の位置が2s軌道と2p軌道3つとバラバラであり、エネルギー的に不安定だと考えられます! (Ⅱ):そこで互いに反発を避ける様にメタン分子:CH4を形成するための軌道編成が行われ、2s軌道のエネルギーと、2p軌道のエネルギーとの間に新しいエネルギーを持つ互いに反発する事のないC原子を中心とした安定した正四面体の4つの新しい軌道が形成されます。これがsp3混成軌道になります! エチレン:C2H4は二重結合を形成している鎖式★不飽和★炭化水素でアルケンと呼ばれます。二重結合のC=C間の1本はσ結合、もう1本はπ結合、そして2つのC-H間にそれぞれ1本ずつのσ結合が2本あります! 2つの正三角形の頂点を平面上に少し重ね合わせた様な構造で、結合角度(H-C-H間、2つのH-C-C間)は大まかですが、全て約120°です! この不飽和結合(二重結合内にπ電子2個)を他の原子・原子団が容易に断ち切り、そこに他の原子・原子団が結合して、アルカンのエタン:C2H6が生成する付加反応([1]エチレン:C2H4と水素:H2を反応させる場合触媒を用いますが、[2]エチレン:C2H4とハロゲン単体である塩素:Cl2と臭素:Br2の反応は触媒無しで良いとされていて、それぞれ1,2-ジクロロエタンと1,2-ジブロモエタンが生成します)が起こります!」 [1]★アルケン/エチレン:CH2=CH2 +H2 → (触媒に白金:Ptかニッケル:Ni) → ☆アルカン/エタン:C2H6 [2]CH2=CH2 + Cl2(Br2) → CH2Cl-CH2Cl(CH2Br-CH2Br) さらに、分子量の小さいエチレン:C2H4(単量体=モノマー)から分子量の大きいポリエチレン(重合体=ポリマー)、同じく分子量の小さいプロピレンC3H6から、分子量の大きいポリプロピレンとして高分子化合物が生じる反応を重合、付加反応による重合を付加重合と言い、やはり二重結合のC=C間のπ結合を断ち切って生じる反応です! 結局★アルケンの不飽和★とは、C=C間の二重結合内のσ結合ではないπ結合が他の原子や原子団に容易に断ち切られ、付加反応が生じる事になります!C-H間でσ結合を形成する☆飽和化合物のアルカンによる置換反応と、C=C間の二重結合の内のπ結合が断ち切られ付加反応が生じる★不飽和化合物のアルケンとのおおよその違いがイメージ出来たのではないでしょうか? あとエチレン:C2H4でイメージしにくいのが、2p軌道に残されたπ結合によるπ電子の軌道の位置です。σ結合の3つは平面上にありますが、π結合によるπ電子は2p軌道の2pz軌道と考えられ、C=C間の「二重結合:=」の1本がπ結合のπ電子として、正三角形の平面に対して垂直に2本立っており、2つのC原子の原子核から離れた空間をクーロン力に引き付けられながら分布しているといった様なイメージです! つまり、sp2軌道(2s軌道と2p軌道との間の新しい軌道=2s軌道+2px軌道+2py軌道)はx、y軸の平面上にあり、あと2p軌道に残されたz軸の2pz軌道だけがC=C間のσ結合に逆らって垂直に2本立っているという様なイメージです! アセチレン:C2H2は三重結合を形成している角度180°の直線型の鎖式★不飽和★炭化水素で、アルキンと呼ばれます。直線上のC-H間は1本のσ結合、三重結合の「C≡C間」は直線上の1本のσ結合と、2本のπ結合から形成されています! z軸の1本のπ結合は直線上に対して垂直の2pz軌道、y軸のもう1本のπ結合は2py軌道として反応性の高い軌道を形成しています! 3CH≡CH → Fe(触媒) → C6H6 sp2混成軌道の1本のπ結合と同様に、アセチレン:C2H2の2本のπ結合による4個のπ電子もまた、水素:H2と触媒によって付加反応(塩素:Cl2、臭素:Br2とは触媒無しに反応)を起こします。 【 ★アルキン/アセチレン(※ π電子4個):CH≡CH+H2 → 触媒:Pt(白金)かNi(ニッケル) → ★アルケン/エチレン(※ π電子2個):CH2=CH2+H2 → 触媒:Pt(白金)かNi(ニッケル) → ☆アルカン/エタン(※ π電子0個):C2H6 】 「※ ここでも、アルキンのアセチレン:C2H2の★不飽和★という状態についてですが、三重結合であるC2H2は、C≡C間に1本のσ結合と、2本の反応性の高いπ結合によって形成されています。 上記の様に、アルキンの状態で2本あったπ結合が、アルケンの状態になるとπ結合が1本になり、最後にはアルカンの状態で、π結合が無い0本となり、σ結合1本だけが残っています!」よってこれをまとめると、 【※ ★不飽和の三重結合アルキン★(σ結合1本、π結合2本) → ★不飽和の二重結合アルケン★(σ結合1本、π結合1本) → ☆飽和のアルカン☆(σ結合1本、π結合0本)】となります! 【※ 飽和状態の単結合アルカン/メタン:CH4(単結合=σ結合4本、π結合0本=π電子0個)は、反応性の高い(電子を奪われ易い)π電子を持たないため、付加反応は生じない!】 【※ 不飽和状態の二重結合アルケン/エチレン:C2H4(二重結合内に、単結合=σ結合1本、π結合1本=π電子2個)は、反応性の高いπ電子2個を持つため、付加反応を生じる!】 【※ 不飽和状態の三重結合アルキン/アセチレン:C2H2(三重結合内に、単結合=σ結合1本、π結合2本=π電子4個)は、反応性の高いπ電子4個を持つため、付加反応を生じる!】 この負(-)に帯電している「-O^-」のπ電子が本来のカルボニル基:-C(=O)-側に移動すると、今度は本来のカルボニル基:-C(=O)-が負(-)に帯電します。2つの同じ軌道空間は交互に負(-)に帯電し(※ これを2つの1/2δ-で表しています!)繰り返し行われる事(※ π電子の非局在化)をイメージして下さい。 結果2つのカルボニル基:-C(=O)-との間に新しい軌道の重なり(形式上2つのsp2混成軌道が形成されているため、2つの2p軌道同士の重なりではないかと考えられます)が生じます。 つまり、「-O^-」のローンペアがカルボニル基:-C(=O)-のπ軌道と共鳴し合う(※ 共鳴は字の通りの意味としてイメージして下さい!)事によって、H^+が電離してもエネルギーの低い酢酸イオンCHзCOO^-がアニオンとして生成し安定出来るのではないかと考えられます! この原子核の存在も最重要として考えますと、酢酸CHзCOOHが陰イオン:CHзCOO^-として安定出来るおおよその予測に役立ちますので、原子核の存在を意識し習慣付けた方がいいのではないでしょうか? 追記として、先程の原子核なんですが、原子は原子核と電子から形成され、原子核は、陽子(+)と中性子(電気的に中性)から出来ていて、陽子が正の電荷(+)を帯びているために原子核は正(+)の電荷を帯びています。 更に、原子核の陽子と中性子はそれぞれ、3つのクォークというものから出来ているそうです。このクォークによって陽子(3つのクォークから出来ている!)、中性子(3つのクォークから出来ている!)として原子核を形成しているそうです! この事は大変ためになる書物から重要知識として引用しましたが、これは無限大に相当難しい事で、発見された方はとてつもなく偉大ですね!】 この現象を水によく溶ける、低級アルコール類であるメタノール:CHзOH、エタノール:C2H5OH、プロパノールC3H7OH等と比較するとイメージしやすいです。メタノール、エタノール等は酢酸以上に元々電離しませんが、仮に電離してもすぐ元のメタノール:CHзOH、エタノール:C2H5OHに戻ってしまいます。 つまり、メタノール、エタノールが酢酸イオンCHзCOO^-の様に、メトキシドイオン:CHзO^-、エトキシドイオン:C2H5O^-として生成しても、陰イオンとしてエネルギー的に安定出来ないという事であり、すぐに元のメタノール:CHзOH、エタノール:C2H5OHに戻った方がエネルギー的に安定し楽になると考えられます。 これをメタノール:CHзOHとエタノール:C2H5OHのヒドロキシ基:-OHの酸素原子:Oに注目して考えますと、どちらの酸素原子:Oも「-C-OH」間で、炭素原子:Cと水素原子:Hを酸素原子:O側に引き付けており、CとHのどちらの原子も正(+)に帯電し、酸素原子:Oは負(-)に帯電し分極していると考えられます。 さらにこの事を、酢酸イオンと何が違うのか考えてみますと、メタノールとエタノールの場合、仮にヒドロキシ基:-OHからH^+が電離しても、H^+から受け取った電子が酸素原子:O上の空間にだけ電子が存在(電子の局在化)し負(-)に帯電し分子内を非局在化出来ない、つまり他の原子との軌道の重なりがない状態にあり、酢酸イオンの様にπ電子が分子内の広い空間を非局在可出来ないために不安定になるのではないかと考えられます。 そのためH^+が電離しても「-O^-」が負(-)に帯電している分、電離したH^+を引き付け配位結合し、元の状態に戻り安定するのではないかと予測されます! [2]CHзOH+H2O⇔CHзO^-+HзO^+(酢酸よりも、さらに左に平衡が大きく偏っている!) [3]C2H5OH+H2O⇔C2H5O^-+HзO^+(メタノールよりも、左に平衡が大きく偏っている!) またこれらは全てヒドロキシ基:-OHを所有しているという別な角度から考えてみると、同じ官能基を所有する酢酸、メタノール、エタノールは何故電離度α(1をMAXとした、H^+を放出する割合の数値)がそれぞれ違うのか?という疑問に到達します。 この疑問については、同じ官能基:-OHと言っても酸素原子:Oが水素原子:Hを引き付ける強さの度合いがそれぞれ違うために、H^+を放出する電離度αも違ってくるのではないかと考えられます。 結局低級アルコールの場合、陰イオンになったとしてもすぐ、元のメタノール、エタノール、プロパノールに戻りたいという事なんですね。とはいっても、酢酸も弱酸ですので、結局はあまり電離したくないという事には変わりありません! 【 CHзCOOH >> CHзOH > C2H5OH 】 になるそうです。この様に考えると、「酢酸はアルコール類と比較すると、※ 強酸!」だとも言えそうですね! いよいよ次回は弱酸のpHを求めていこうかなと思います。別記事でも少し触れましたが、pHを求めるためには数多い公式を理解しながら繋げていかなければなりません。 そこで、後々加水分解にも応用化出来るように、私なりに考えた独自の「あるある的公式」として紹介していこうと思っていますので、宜しかったらお付き合い下さい!それではこの辺で、 See you ! 1-2.電気陰性度の持つ大きな役割!
2.酢酸CHзCOOHの構造って、一体どうなっているの?
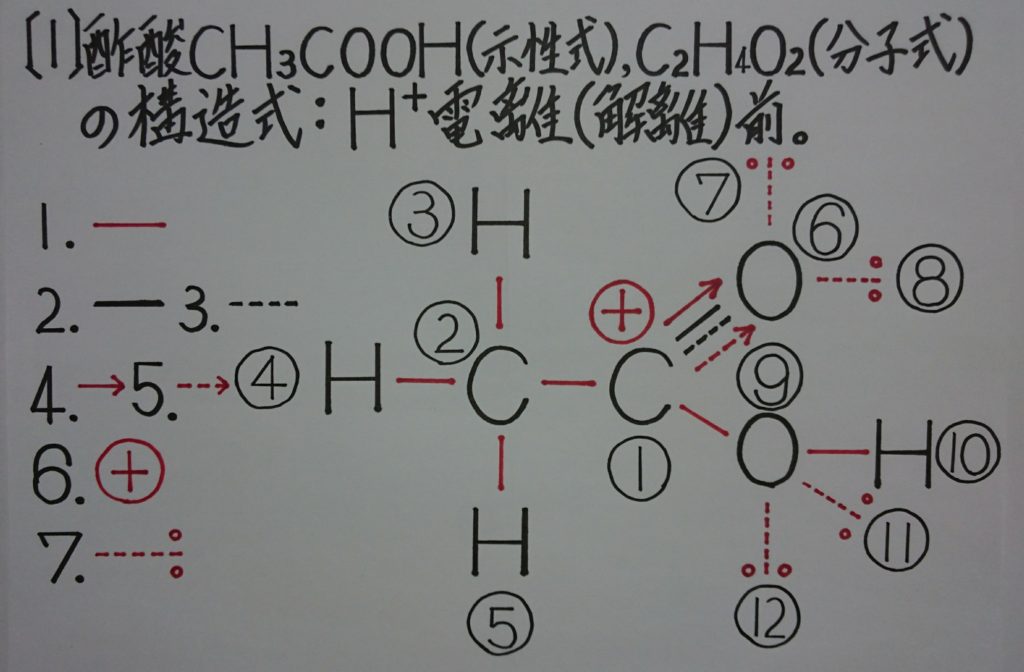


3.混成軌道形成の最重要ポイント「※ 炭素原子:Cの2s軌道の電子2個は、昇位に1個、混成軌道に1個使われ、電子0個となり無くなってしまう!?」
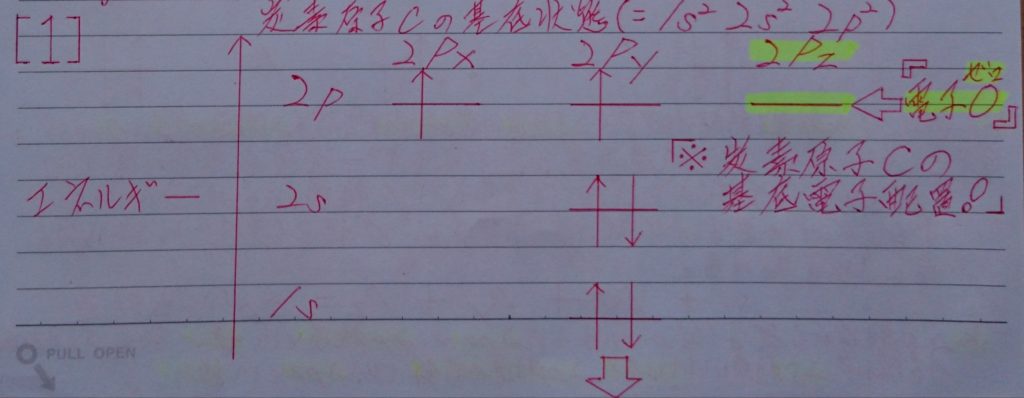

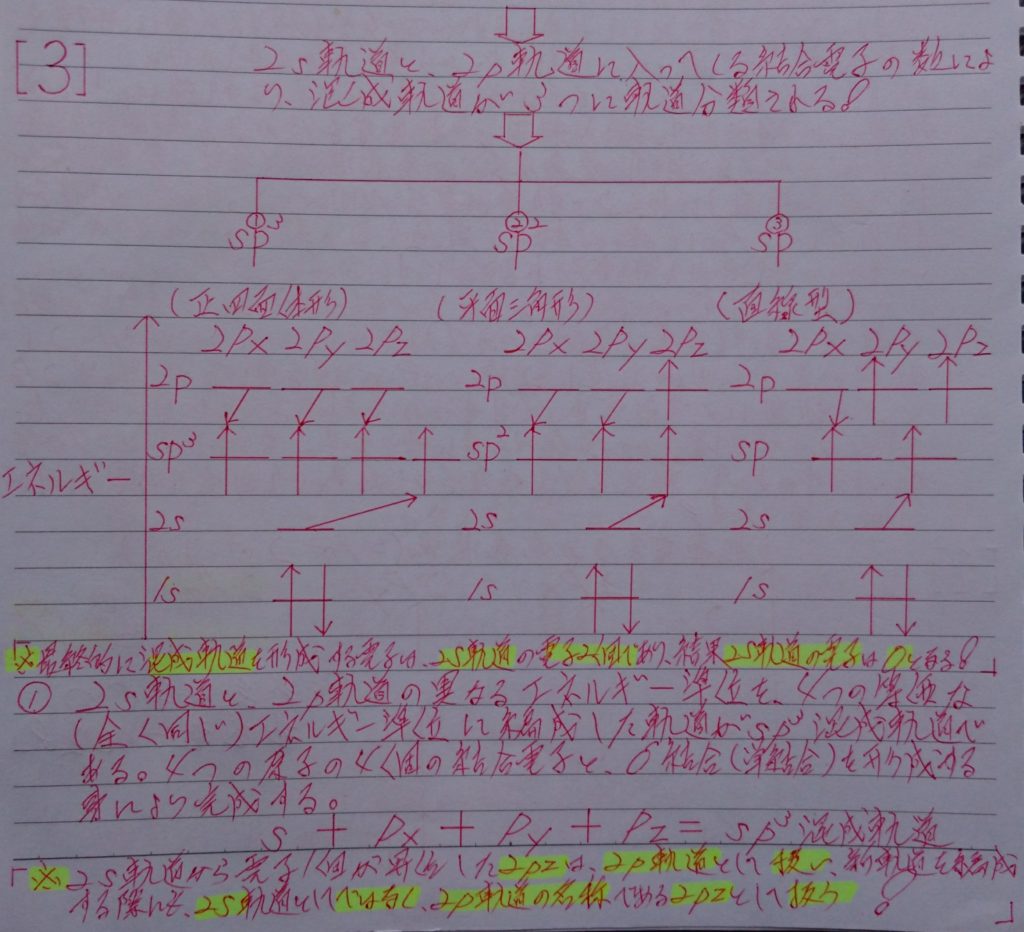
4.混成軌道から、有機(鎖式)化合物の飽和化合物(単結合=σ結合)と不飽和化合物(二重結合=σ結合とπ結合 & 三重結合=1本のσ結合と2本のπ結合)の仕組みを解き明かそう!
4-1.不飽和結合(二重結合、三重結合)に関与しているπ結合によるπ電子の化学反応性!
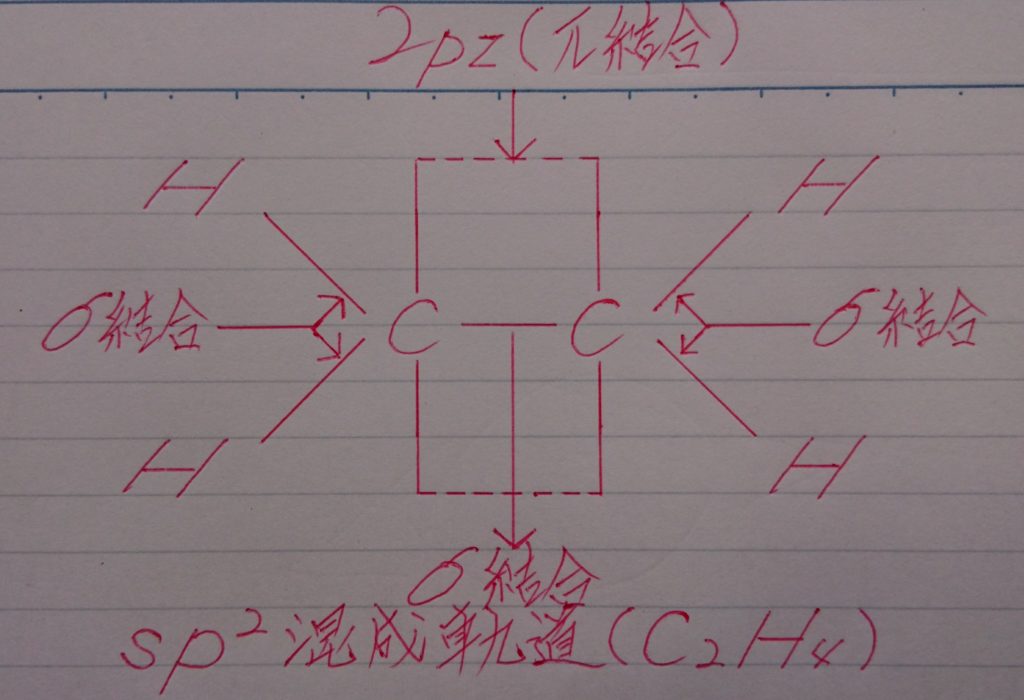
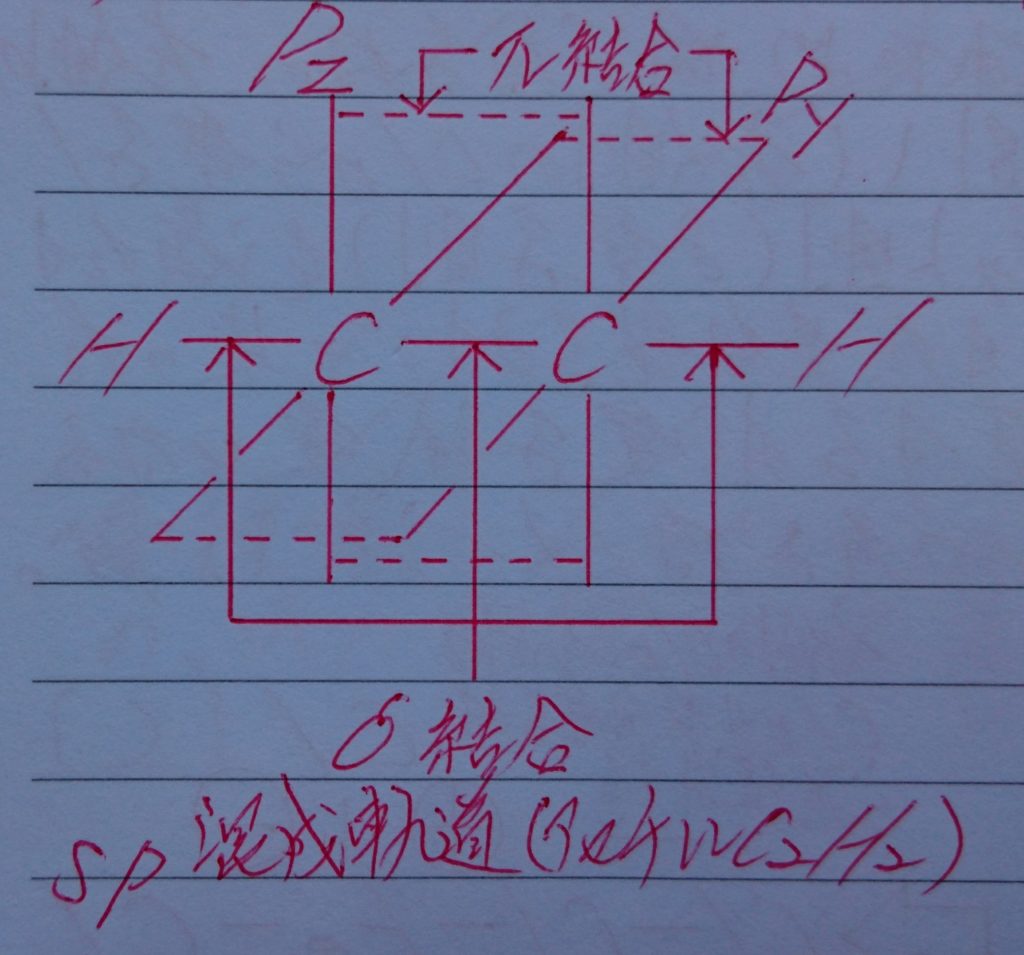
5.酢酸電離後の酢酸イオンCHзCOO^-の構造の予想図。
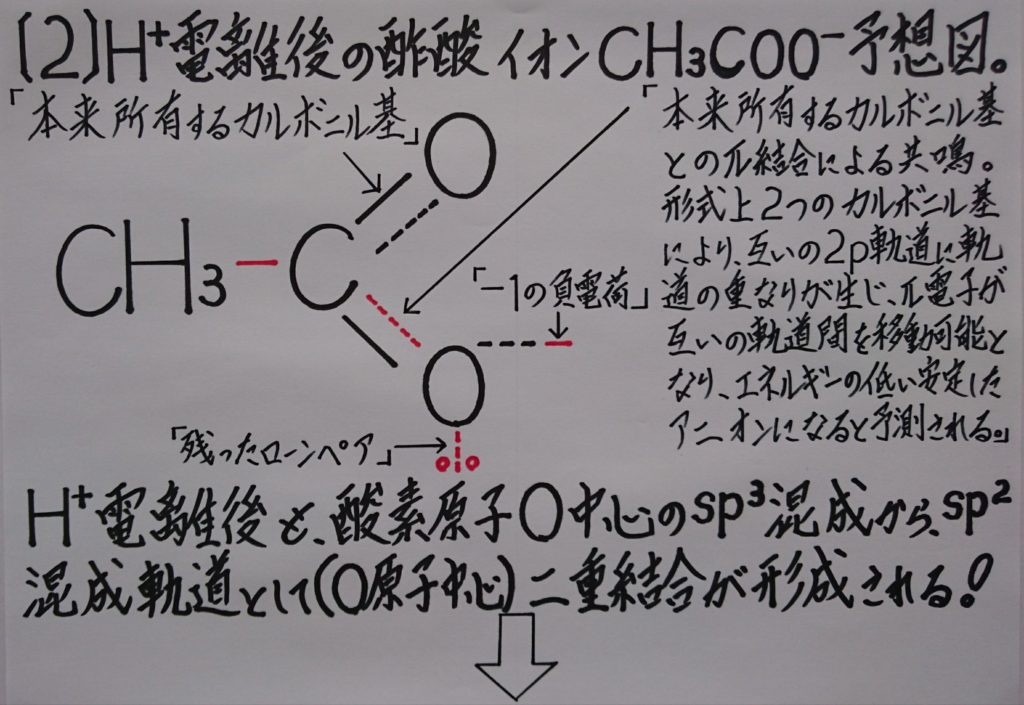
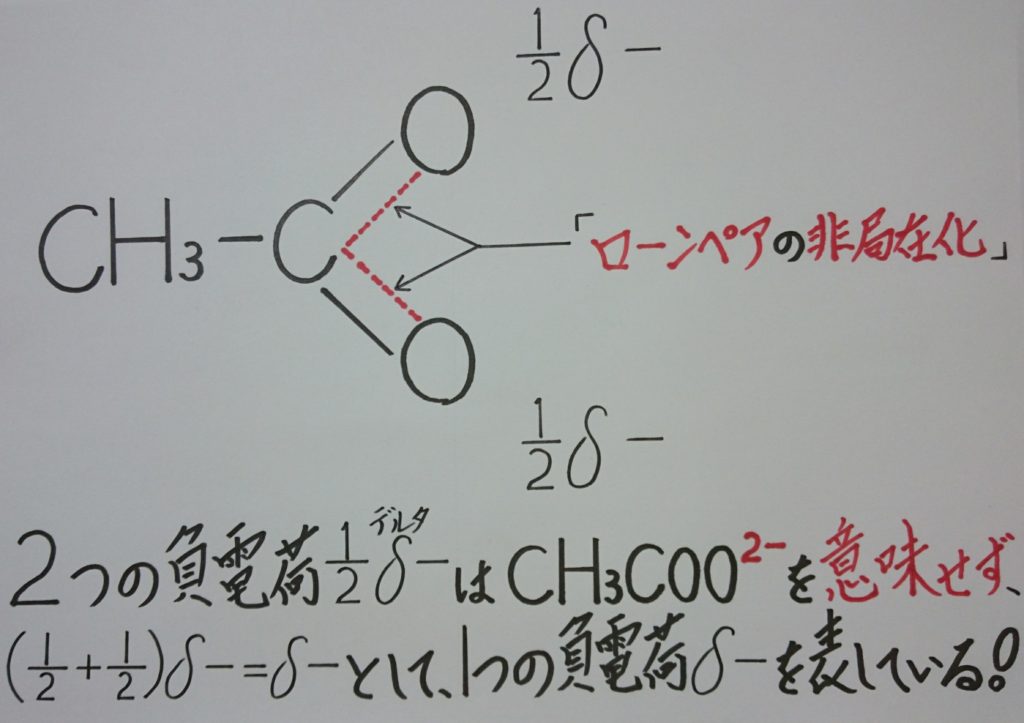
5-1.原子核のちょっとした知識!
5-2.酢酸と、アルコール類の違いとは?




















