今回は、三重結合、二重結合と珍しい組み合わせとなる「ジアゾ化&カップリング(ジアゾカップリング)!」について話を進めて行きたいと思います。
ジアゾ化&ジアゾカップリングの考え方と致しましては、ハロゲン化、ニトロ化、スルホン化と同様に、まず求電子剤を生成させる事から始まります。
【✺ ハロゲン化・ニトロ化・スルホン化+クメン法の記事はこちらから是非御覧下さい!】
「これぞ明解!ベンゼンから、クロロベンゼンが誕生する仕組み!」
「上級名答!ベンゼンから、ニトロベンゼンが誕生する仕組み!」
「絶対太鼓判!ベンゼンからベンゼンスルホン酸が誕生する仕組み!」
「全集中フル回転!実はクメン法、凄い神技だらけの宝庫だった!」
ジアゾカップリングでは、窒素N2の三重結合が少々厄介だと思われますが、最終的には電子の帳尻を合わせる事になりますので、電子の動きを追って頂きクリアされたらと思います。
それではスタート致しましょう!
1.ジアゾ化&カップリングとは?

このアゾ化合物の中でベンゼン環を所有する化合物を芳香族アゾ化合物と呼び(一般に、黃〜赤色ですが、大まかにオレンジ色・橙色をイメージして頂けたらと思います!)、アゾ染料・食品の着色料・ph指示薬(メチルオレンジ、メチルレッド等)として幅広く扱われています!
1−2.ジアゾ化!
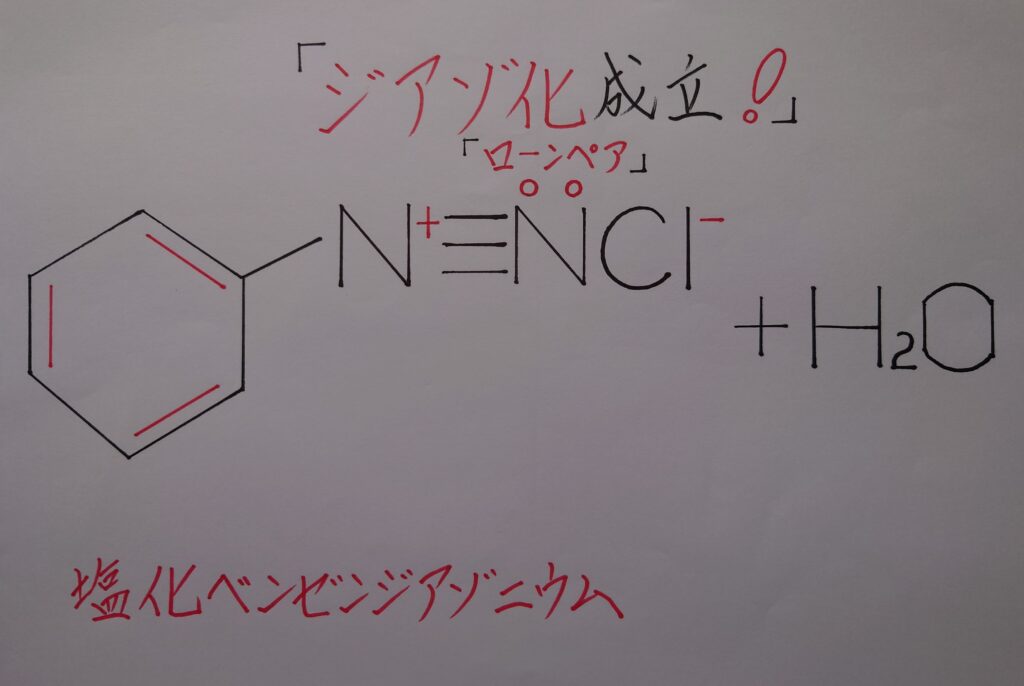
ジアゾ化は最終的に「塩化ベンゼンジアゾニウム(ジアゾニウム塩)C6H5−N^+≡NCl^-」が生成されますが、それにはアニリンC6H5NH2を加えた希塩酸水溶液(HCl水溶液)を「❋ 5℃以下」に冷却しながら亜硝酸ナトリウムNaNO2水溶液を加え作用させる必要があり、これらの操作を終了させる事で、「塩化ベンゼンジアゾニウム(ジアゾニウム塩)C6H5−N^+≡NCl^-」が生成されます。
ジアゾ化では、ベンゼン環と三重結合である「N2↔N≡N」とが結合し塩として存在しています。このN2による三重結合により少々理解しづらい反応となっていますが、まずはこのN2による三重結合に欠かせない求電子剤を生成させる事から始めていきましょう!
1−3.ジアゾ化による求電子剤・塩化ニトロシルNOCIの生成!
2つの塩はそれぞれ、「❋ 塩化ベンゼンジアゾニウム(ジアゾニウム塩)と、塩化ナトリウムNaCl」です!
「 C6H5NH2(アニリン)+ 2HCl(希塩酸) + NaNO2(亜硝酸ナトリウム)→ 〔ジアゾ化・5℃以下に冷却〕 C6H5−N^+≡NCl^-(塩化ベンゼンジアゾニウム) + NaCl(塩化ナトリウム)+ 2H2O(水) 」
この様に塩・塩化ナトリウムNaClと水H2Oが生成するという事は、明らかに「❋ 希塩酸HClと、亜硝酸ナトリウムNaNO2が真っ先に反応している!」と言えます!
ここで、それぞれの反応を分けて考えますと、次の様な反応となります。
[1]NaNO2(亜硝酸ナトリウム)+ HCI(希塩酸)→ HNO2(亜硝酸)+ NaCI(塩化ナトリウム)
[2]HNO2(亜硝酸)+ HCI(希塩酸)→ NO^+(❋ ニトロソニウムイオン)+ CI^-(塩化物イオン)+ H2O(水)
[1]+[2]より、両辺のHNO2(亜硝酸)を互いに消去すると次の様に表せます!
「 NaNO2(亜硝酸ナトリウム)+ 2HCI(希塩酸)→ NOCl(塩化ニトロシル)+ NaCI(塩化ナトリウム)+ H2O(水) 」
この様な反応により、アニリンC6H5NH2と引き寄せ合う事が可能な強力な求電子剤・塩化ニトロシルNOClが生成されます!
「 NO^+(❋ ニトロソニウムイオン)+ CI^-(塩化物イオン)→ NOCl(❋ 塩化ニトロシル)」
であり、塩化ニトロシルNOClとして金Auをも溶かす強酸の「王水(濃硝酸HNO3︰濃塩酸HCl=1︰3)」にも存在しており、強い酸化力を所有しています!】
《❋ 塩化ニトロシルNOClを含んだ王水・金Auの反応と酸化数!》
[1]HNO3(+1・✧+5・−2×3)+ 3HCl(+1×3・(✪−1×2)+(−1)) → NOCl(✧+3・−2・−1)+ Cl2(✪0)+ 2H2O((+1×2×2)・−2×2)
[2]Au(✭0)+ NOCl(✧+3・−2・−1)+ Cl2(✪0)+ HCl(+1・−1)→ NO(✧+2・−2)+ H[AuCl4](+1・✭+3・−1×2+✪(−1×2))
少々見づらいですが、最終的にはH[AuCl4]〔テトラクロロ金(Ⅲ)酸〕が生成し、金Auが酸化され、窒素Nと塩素Cl2が還元されている事が解ります!
【❋ また白金Ptも金Auと同様に、王水に次の反応によって溶けます!
「 Pt(白金)+ 2NOCl + Cl2 + 2HCl → H2[PtCl6]〔ヘキサクロロ白金(Ⅳ)酸〕+ 2NO 」
因みに「白金Ptの酸化数は、+4」です!
この様に塩化ニトロシルNOClは強い酸化力を所有しています。これを踏まえて、亜硝酸ナトリウムNaNO2と塩酸HClより塩化ニトロシルNOClが生成する反応からスタート致しましょう!】
2.求電子剤・塩化ニトロシルNOClの生成する過程!
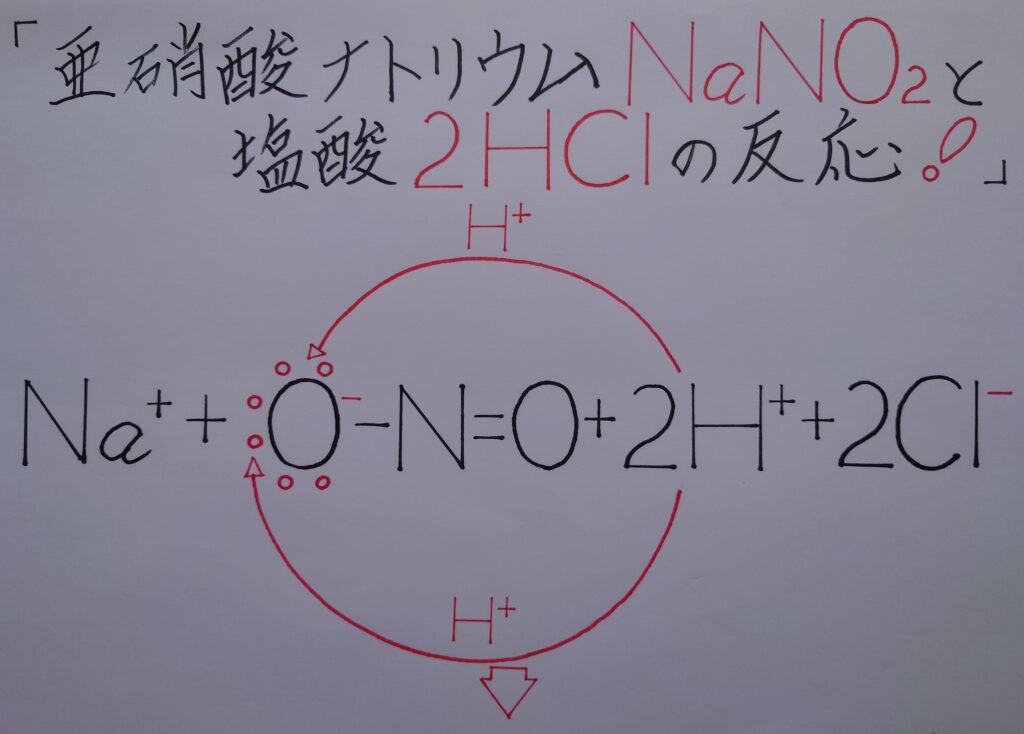
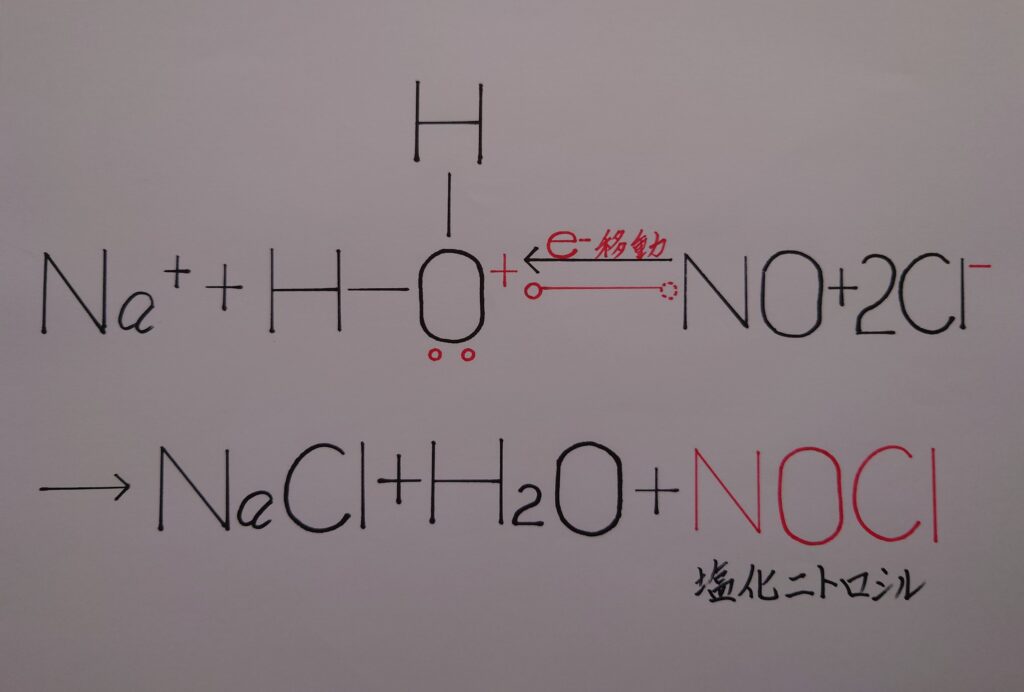
次に亜硝酸HNO2と塩酸HCIにより、ここで塩化ニトロシルNOClが生成すると言った様に、案外容易にNOClが生成しています。またこれらの反応を電子の動きとして上画像で表した内容は次の様になっています。
上1番目の画像では、塩酸2HCIの水素イオン2H^+が亜硝酸イオンNO2^-内でσ結合を形成している酸素原子Oに配位結合しています。そしてこの時、負(−)に帯電していた酸素原子Oは2つの正電荷(+)の水素イオン2H^+により、次の画像では正電荷(+)を帯びる事になります。
これにより、酸素原子Oとσ結合を形成していた窒素NはOとの共有電子対ごとOから奪われ、今度はNが正電荷(+)を帯びニトロソニウムイオンNO^+となり、塩化物イオンCI^-と塩化ニトロシルNOClを形成します!
実際にはこの生成した陽イオンである、「❋ ニトロソニウムイオンNO^+がアニリンC6H5NH2と反応し合う!」事になりますので詳しく観ていきましょう!
3.塩化ニトロシルNOClとアニリンC6H5NH2の反応により、塩化ベンゼンジアゾニウムC6H5−N^+≡NCl^-が生成される!
ここからいよいよ生成した塩化ニトロシルNOClと、アニリンC6H5NH2が反応し合います!
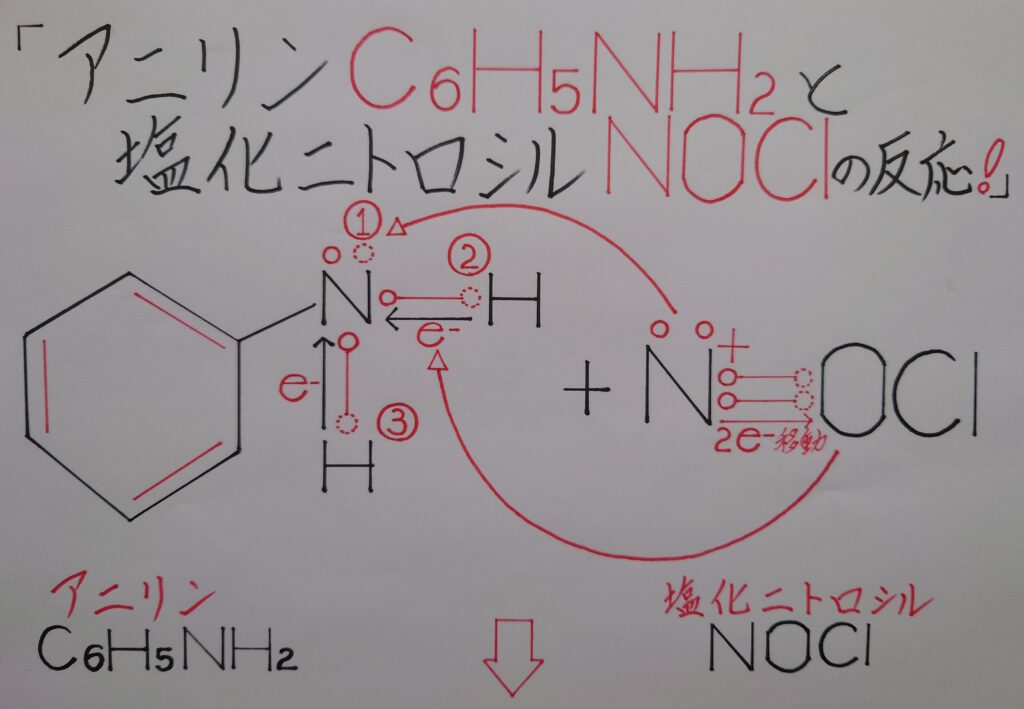
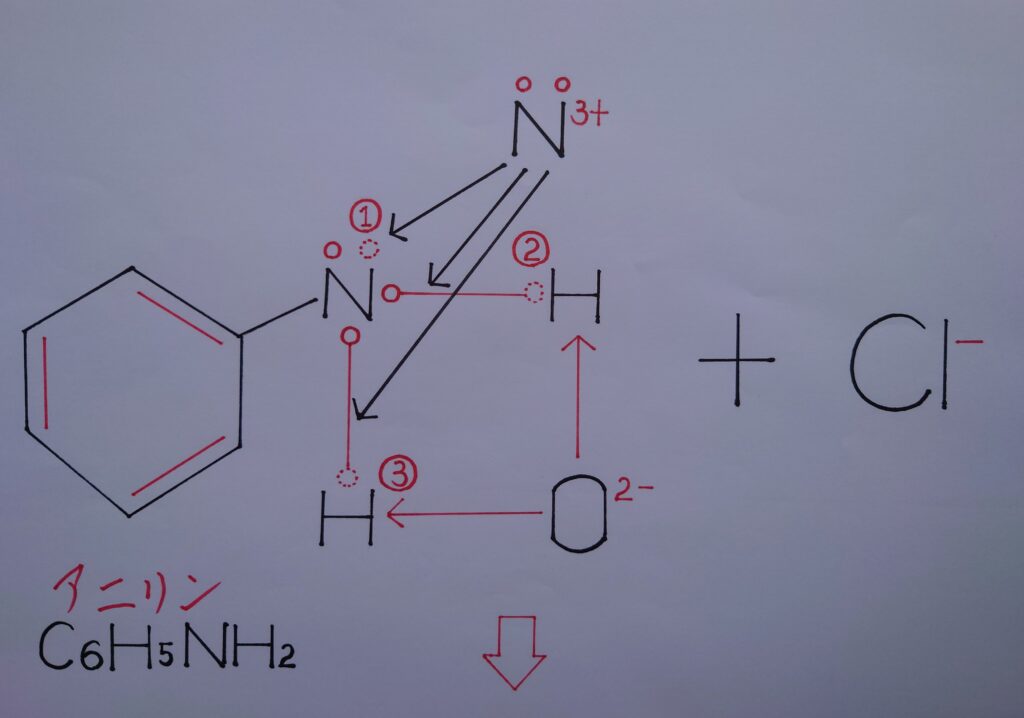
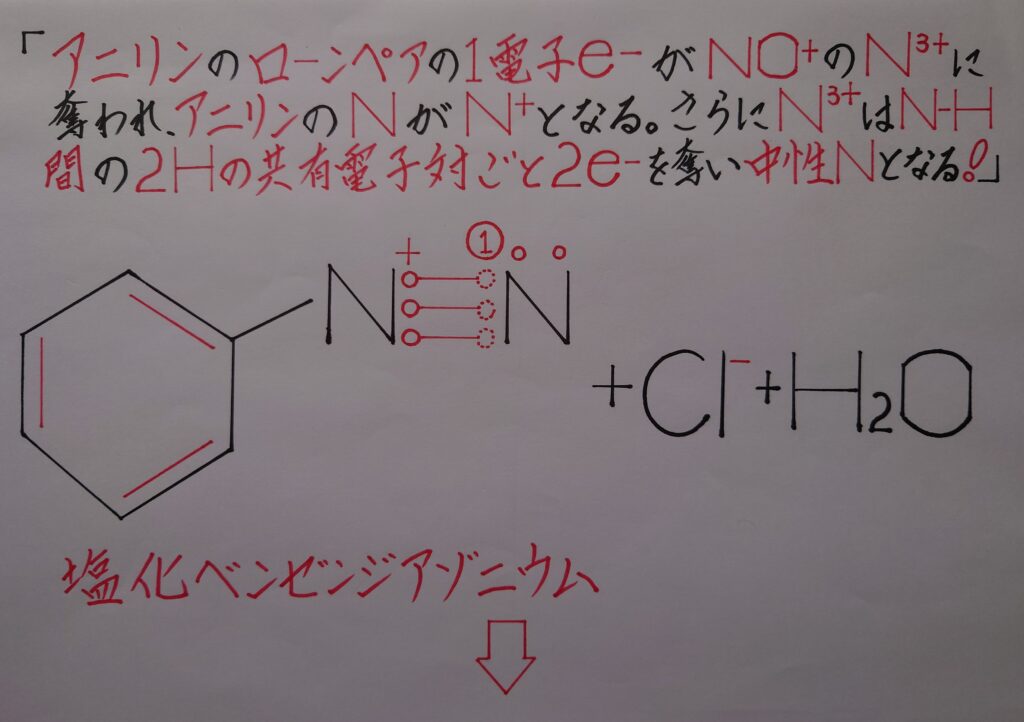
上画像では理解しやすい様にニトロソニウムイオンNO^+をN^3+(❋ 元々Nは1電子を失っており、酸素原子Oからも2個の電子を奪われていると考えた場合、合計電子3個を失っているのでN^3+として表しています!)と、酸化物イオンO^2-(❋ NO^+内の酸素原子OがNから2電子を奪いO^2-としています!)とに分けてあります。
まずO^2-から考えますと、アニリンC6H5NH2のN原子が電気陰性度の差から2つの水素原子HをN側に引き付けているため正(+)に偏り、O^2-が水素イオン2H^+として反応し合い最も安定した水H2Oが生成されます。
次いでN^3+がアニリンの(1)のローンペア(非共有電子対)を奪い、同じくアニリンが2つの水素原子Hから奪った2つの共有電子対をN^3+が奪います。合計3個の電子を奪いN^3+からNになり、逆にアニリンのNがローンペアの電子1個を失いN^+と正電荷(+)を帯び、結果塩化ベンゼンジアゾニウムC6H5−N^+≡NCl^-が生成する事になります!
この塩化ベンゼンジアゾニウムC6H5−N^+≡NCl^-と、ナトリウムフェノキシドC6H5ONaが最終段階の反応となります。
4.カップリング(ジアゾカップリング)により、ジアゾニウム塩とフェノール類を反応させるとアゾ化合物・p−ヒドロキシアゾベンゼン(p−フェニルアゾフェノール)が生成する!
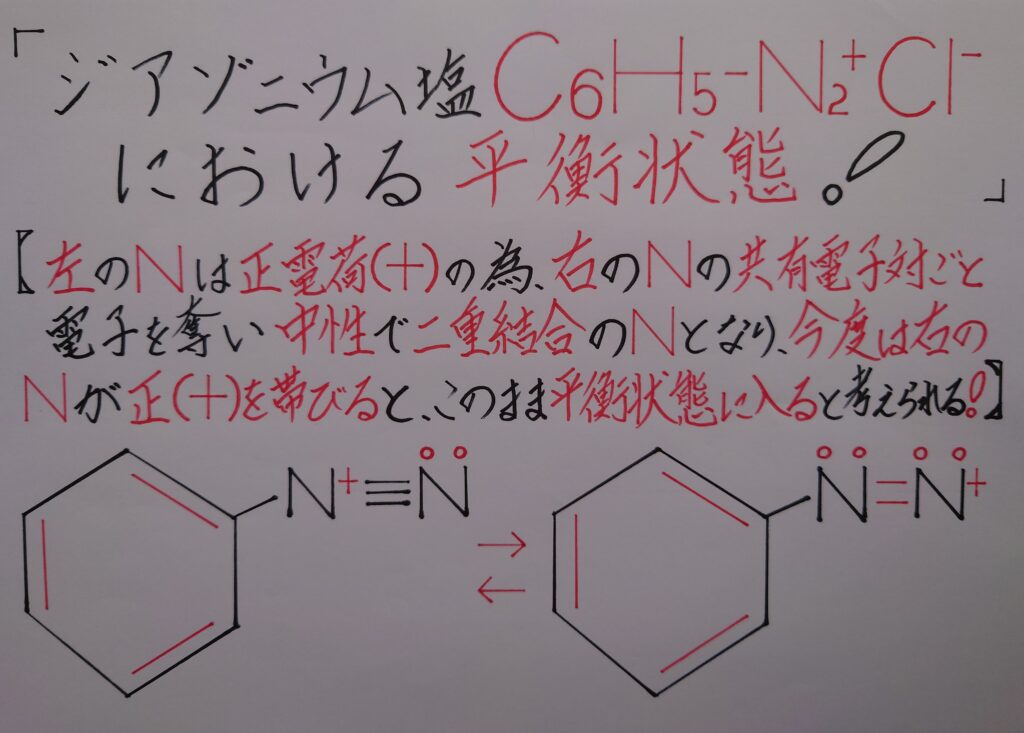
カップリングを考える場合、ジアゾニウム塩C6H5−N2^+Cl^-の「N^+≡N」の部分に着目してみます。
2つのNは電気陰性度は同じですが、左側のNは正(+)に帯電している為、右側のNとの共有電子対ごと引き寄せ奪うと、今度は右側のNが正(+)に帯電している状態になります。
結局、この反応が平衡状態となってナトリウムフェノキシドC6H5ONaと反応し合う事になります!
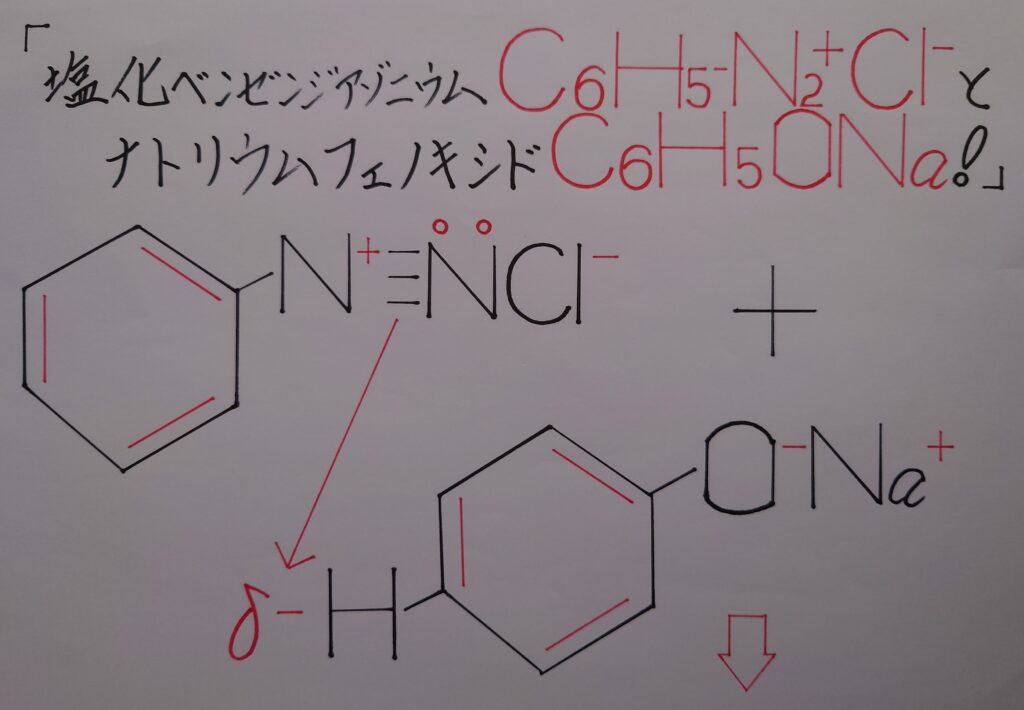
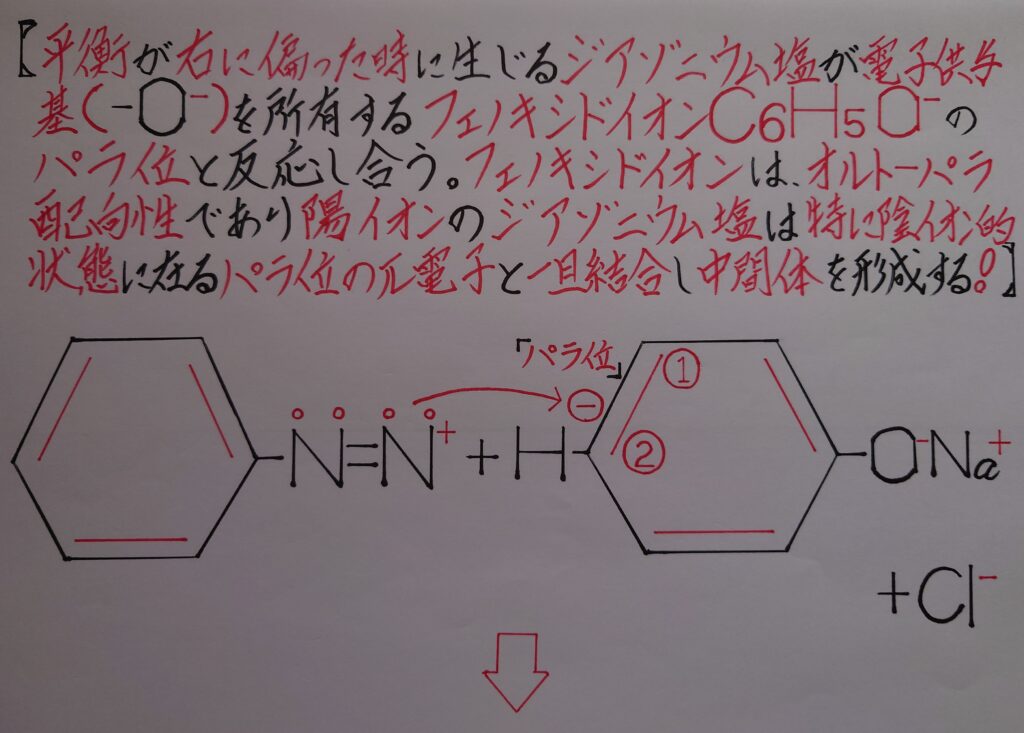
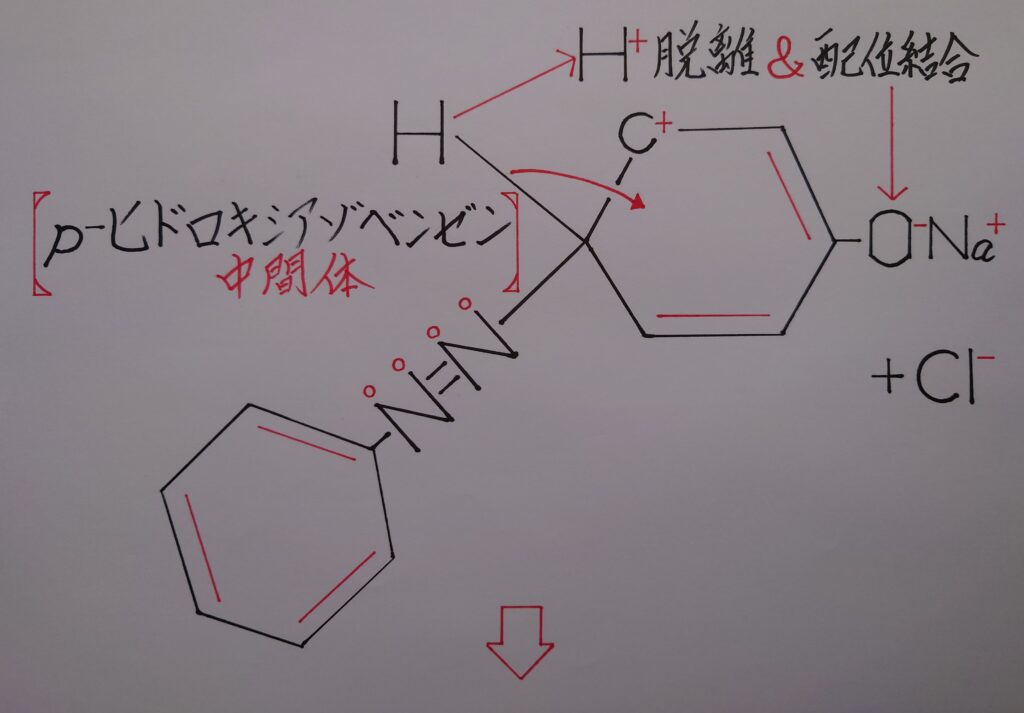
この時(1)の炭素Cはπ電子を奪われた為にカルボカチオンC^+となります。そして、このC^+がC−H間の共有電子対ごと引き寄せ水素原子Hの電子を電気陰性度の差で奪うと、Hは水素イオンH^+として弾かれ酸素原子Oに配位結合します。
つまり、ジアゾニウム塩と水素原子Hとで芳香族求電子置換反応が行われたという事になります!
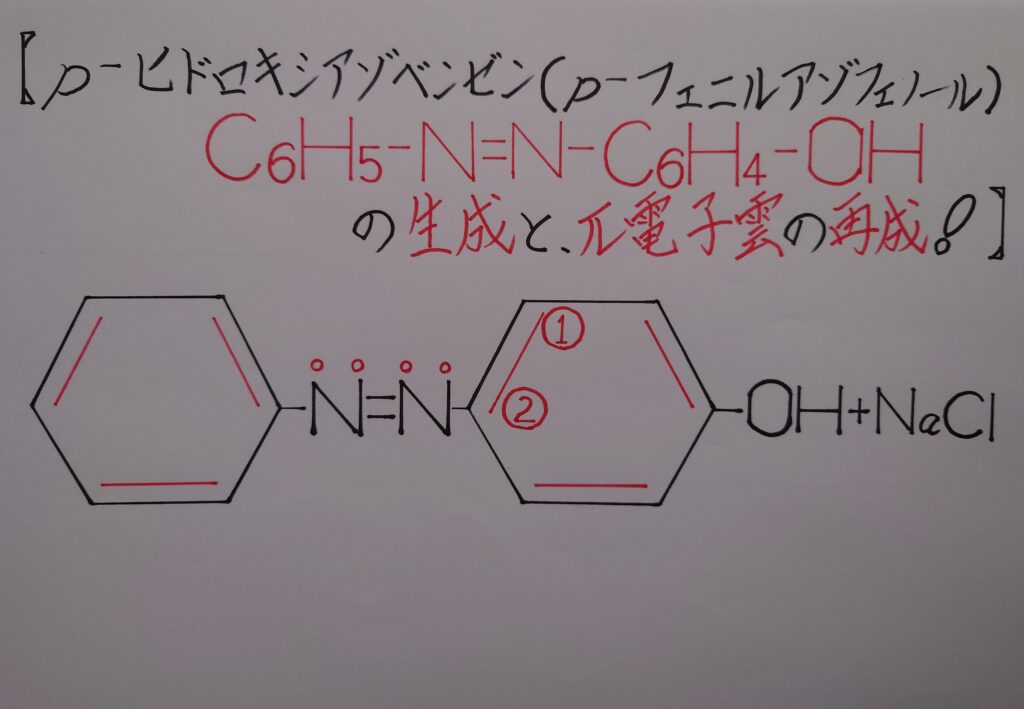
この様な道のりを経て、最終的にp−ヒドロキシアゾベンゼン(p−フェニルアゾフェノール)が生成され、この瞬間(1)−(2)間のπ電子雲も再生されます!
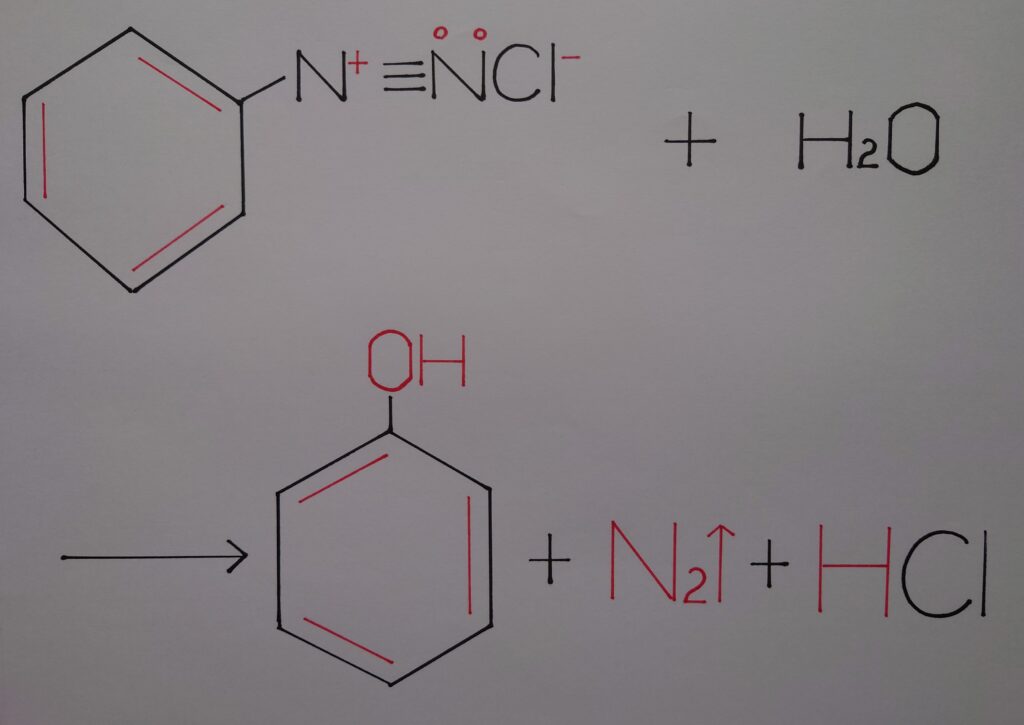
5.塩化ベンゼンジアゾニウムの加水分解!
塩化ベンゼンジアゾニウムは通常の温度(❋ 5℃を上回る温度!)では非常に不安定であり加水分解が起こり、窒素N2が発生しフェノールが生成されます!
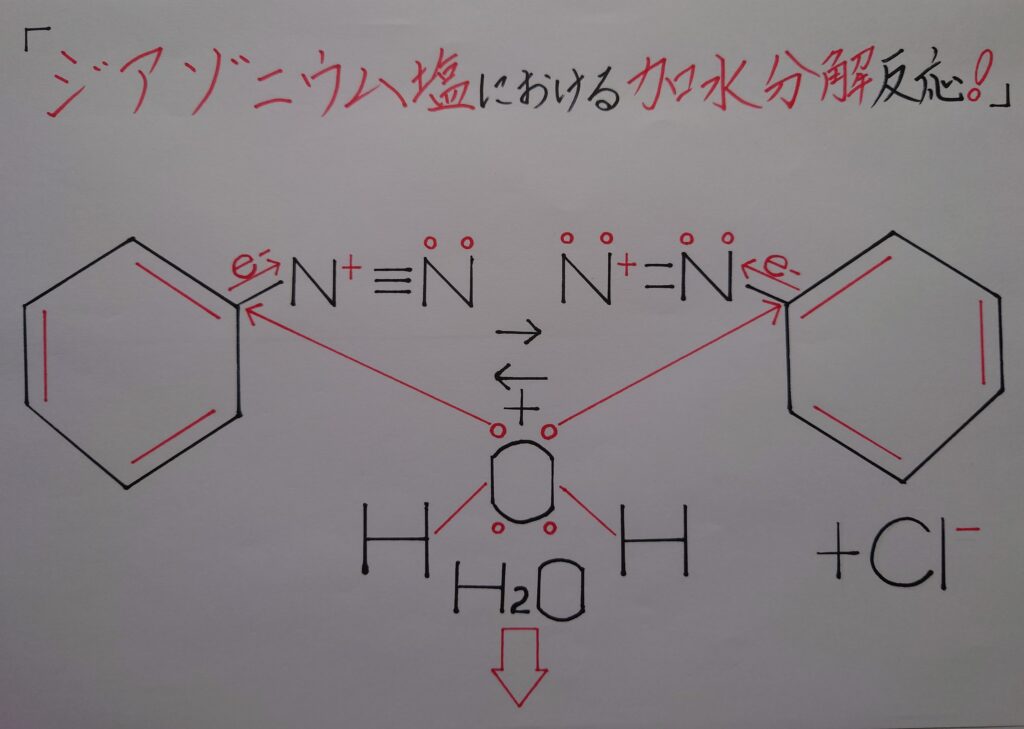
ジアゾニウム塩のC−N間は、電気陰性度の差によって窒素原子Nの方に電子が引き寄せられ炭素原子Cは正電荷(+)に偏っている状態にあると考えられます。そこに水H2Oの酸素原子Oの非共有電子対(ローンペア)が引き寄せられ、一旦炭素原子Cとローンペアによって共有結合が形成されます!
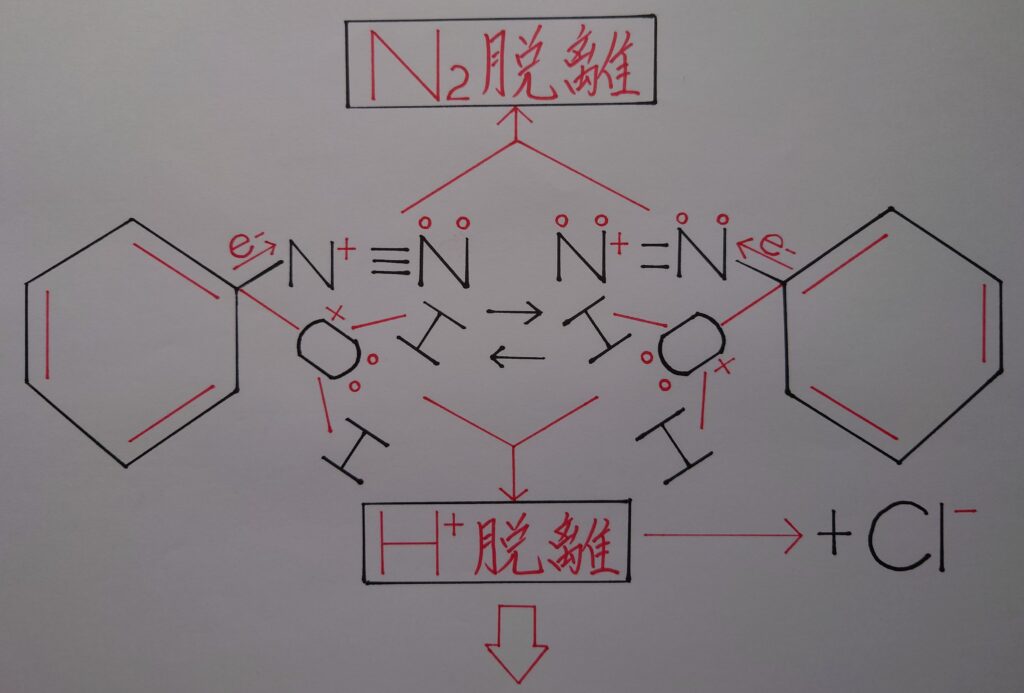
酸素原子Oのローンペアの電子を炭素原子Cに奪われた形になった事でOは正(+)に帯電し、これとH2O内の水素イオンH^+が正電荷(+)同士反発し合いH^+として脱離します!
同時にC原子のオクテット則(8電子則)が破壊され、ここではO原子とN原子の電気陰性度の差によってC−O結合が優先して形成され、C原子の電子1個が完全にN原子側に移動し窒素原子N2として脱離します。
そして最後に、フェノールC6H5OHが生成すると同時にオクテット則が再度満たされ、反応終了となります!
【✺ ジアゾカップリング同様に、混成軌道の別記事も是非御覧下さいね!】
「必見!酢酸CH3COOHの2s軌道が電子0個になる謎とは!?」
今回は、ジアゾ化とカップリングについて話を進めて来ましたが、やはり窒素2Nによる二重結合と三重結合が厄介だったのではないでしょうか?改めて電子の動きを追って頂けたらと思います。
最終的には電子供与基のパラ位で求電子剤による芳香族求電子置換反応によって、p−ヒドロキシアゾベンゼン(p−フェニルアゾフェノール)が生成されます。この反応につきましてはいくつか紹介して来ましたので、皆さん理解しやすかったのではないでしょうか?
さて、今回も永々お付き合い下さいまして誠に有難う御座いました。またの御閲覧宜しくお願い致します!
では、この辺でまた、 See you!




















