ヨウ素I2の滴定による酸化還元反応には、
[1]︰ヨウ素酸化滴定(ヨージメトリー) [2]︰ヨウ素還元滴定(ヨードメトリー)とがありますが、今回は、この2つの滴定について進めていこうかなと思います。
前回紹介致しましたCOD(化学的酸素要求量)に比べて理解しやすいと思いますので、毎回通りイメージの方よろしくお願いします!
【✺ COD(化学的酸素要求量)の別記事は、こちらから是非御覧下さい!】
「決定打はコレだ!COD(化学的酸素要求量)は同じ濃度で終了させるべし!」
1.ヨウ素I2のちょっとした復習!

無極性分子であるI2は極性溶媒の水H2Oにはほとんど溶けませんが、ヨウ化カリウムKI水溶液にはよく溶けて三ヨウ化物イオンI3^-を生成させ(赤[せき])褐色の「❀ ヨウ素溶液」となります。
I2 + I^- ⇆ I3^-
この様にKIのヨウ化物イオンI^-と反応しI3^-が生成されます。このヨウ素溶液に指示薬でもあるデンプンを加えると青紫色(せいししょく)に呈し「❀ ヨウ素デンプン反応」が起こり、これはヨウ素I2の検出に用いられています。
この現象はデンプン分子の螺旋(らせん)構造に起因しており、この螺旋構造の中にヨウ素I2が侵入する事で呈色しています。これを熱すると無色となって青紫色が消失し、再び冷却すると青紫色を呈します。
また薄(うす)褐色のヨウ素I2の飽和水溶液(I2が完全に溶解している状態)にチオ硫酸ナトリウムNa2S2O3水溶液を加えると無色となります。これは、ヨージメトリー・ヨードメトリーの最終段階で行われる滴定でもあります。
I2 + 2Na2S2O3 → 2NaI + Na2S4O6(テトラチオン酸ナトリウム)
[半反応式]︰I2 + 2S2O3^2-(チオスルファト↔チオ硫酸イオンS2O3^2-) → 2I^- + S4O6^2-2.ヨウ素酸化滴定(ヨージメトリー)と、ヨウ素還元滴定(ヨードメトリー)の覚え方について!
私自身、時たま「ヨウ素酸化滴定=ヨージメトリー」、「ヨウ素還元滴定=ヨードメトリー」の両滴定の名称がゴチャ混ぜになって、どちらがヨージメトリーで、どちらがヨードメトリーかを戸惑う事があります。
皆さんは、こういう様に迷った事ないでしょうか?たった4つの名称を同じ意味を表す滴定として頭にインプットするだけなのですが、何故だか間違ってしまう事があるんですよね!
そこで私は、「ヨウ素酸化滴定=ヨージメトリー」だけを完璧に覚える事にしました。これだけを覚えられたら、あとは自然と「ヨウ素還元滴定=ヨードメトリー」は覚えられます。
その覚え方とは、ヨウ素酸化滴定の酸化の酸を、「❁ サン」に、ヨージメトリーの「❁ ジ」だけを取り外し、この2つのカタカナを合わせて「✰ サンジ!」として覚える事にしました!
「✰ サンジ!」聞き覚えがないでしょうか?そうです、アニメ︰ワンピースの、あのコック長「✰ サンジ!」です!
「何だソリャ!」と、ツッコミたくなる人がたくさんいると予想されますが、皆さん、この覚え方は案外間違わない覚え方ですので、一度試されたらいかがでしょうか!イメージまでして頂きますと、こんな感じです。
「サンジが酸(サン)化滴定してる!」姿をイメージして頂きますと、自然と、
「❁ ヨウ素酸(✰サン)化滴定=ヨージ(✰ジ)メトリー」
が成立し完全に間違う事が無くなります!あと残った名称は、
「ヨウ素還元滴定=ヨードメトリー」
だけであり、間違わずに完璧に覚えられますので、一度お試しを!
「オレ酸(サン)ジ!ヨウ素酸化滴定、皆んなも覚えてな!えっ、怒ってないよ、真剣なだけ!」

皆さん、似てなくてごめんなさい_(._.)_!
3.酸化剤︰ヨウ素I2により、還元剤を酸化する段階的詳細図!
そして、還元剤を溶液中の過剰な酸化剤ヨウ素I2に完全に吸収させ、ヨウ素I2の一部を完全に還元し、その一部はヨウ化物イオン2I^-となる!
(2)残った酸化剤ヨウ素I2に指示薬のデンプンを加え青紫色に呈色するヨウ素デンプン反応が生じる!
(3)最後に、チオ硫酸ナトリウム2Na2S2O3により残ったI2を完全に滴定還元するとヨウ化物イオン2I^-となり、溶液中の青紫色が消滅し終了となる!
【❊ ヨウ素酸化滴定(ヨージメトリー)の段階的詳細図!】
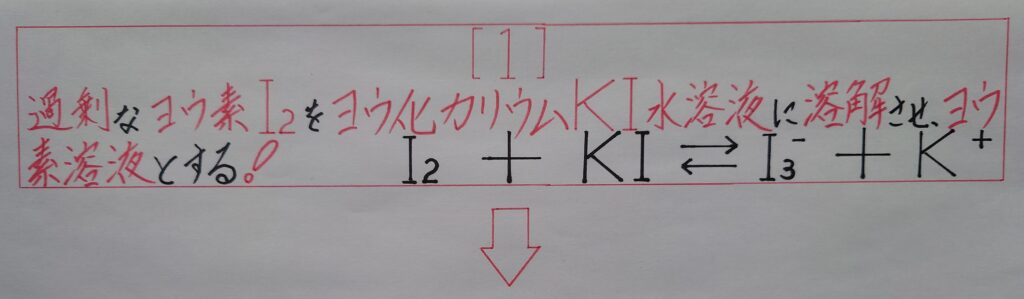


【❅ 1番最初の画像の[1]=2番目と3番目画像の、[1]+[1’]】
として、1番目の画像[1]を、2番目と3番目の画像の[1]と[1’]によって、より詳しく表している所に着目して下さい!』
4.還元剤:ヨウ化物イオン2I^-により、酸化剤を還元する段階的詳細図!
(2)酸化され生成したヨウ素I2に指示薬であるデンプンを加えると青紫色に呈色する(ヨウ素デンプン反応)!
(3)最後に、チオ硫酸ナトリウム2Na2S2O3により酸化されたヨウ素I2を還元すると再びヨウ化物イオン2I^-に還り、青紫色が消滅し終了となる!
【❊ ヨウ素還元滴定(ヨードメトリー)の段階的詳細図!】

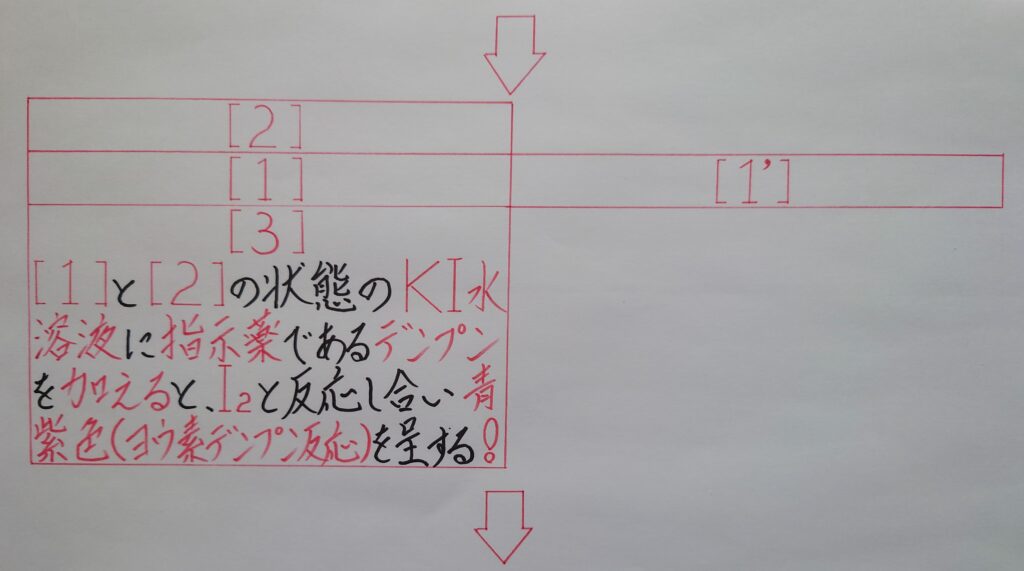
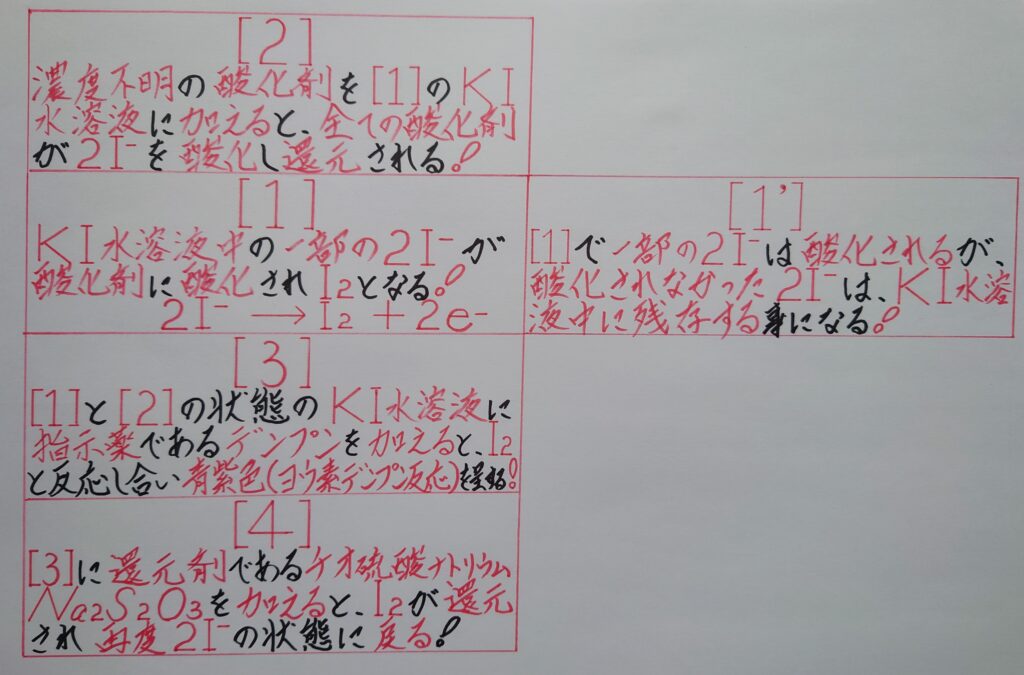
【❅ 1番最初の画像の[1]=1番目と2番目と3番目画像の、[1]+[1’]】
として、1番目の画像[1]を、1番目と2番目と3番目の画像の[1]と[1’]によって、より詳しく表している所に着目して下さい!』
5.ヨージメトリー(ヨウ素酸化滴定)の問題をイメージしながら解いていこう!
「 左辺(還元剤) = 右辺(酸化剤) 」
または、
「 左辺(酸化剤) = 右辺(還元剤) 」
と思い切って考えて頂きますと理解しやすいと思います。さらに酸化還元反応による半反応式が必要とされますので、半反応式を重要視して頂けたらと思います!
(1)ヨウ素溶液中のヨウ素I2が、硫化水素H2Sの硫黄Sと、チオ硫酸ナトリウムNa2S2O3の硫黄Sを酸化する物質量〔mol〕は、半反応式より✰2e^-を受け取る事から、
I2 + ✰2e^- → 2I^-
よってI2の物質量〔mol〕は、
酸化剤I2の物質量〔mol〕︰✰2✕0.20〔mol/L〕✕(40〔mL〕/1000〔mL/L〕)=1.6✕10^-2〔mol〕
となります。
(2)硫化水素H2Sの硫黄Sがヨウ素I2に酸化された物質量〔mol〕をxとして、半反応式より2e^-を放出する事から、
H2S → S + 2H^+ + ✧2e^-
よって還元剤H2Sの物質量〔mol〕は、
還元剤H2Sの物質量〔mol〕︰✧2✕x〔mol〕=2x〔mol〕
(3)チオ硫酸ナトリウムNa2S2O3の硫黄Sが、ヨウ素I2に酸化された物質量〔mol〕は半反応式より✬2e^-を放出し「✼ テトラチオン酸ナトリウムNa2S4O6」が生成される事から、
2S2O3^2-(チオ硫酸イオン↔チオスルファト) → S4O6^2-(テトラチオン酸イオン) + ✬2e^-
よってNa2S2O3の物質量〔mol〕は、
還元剤Na2S2O3の物質量〔mol〕︰✫1✕0.10〔mol/L〕✕(20〔mL〕/1000〔mL/L〕)=2✕10^3-〔mol〕
ここで、チオ硫酸ナトリウムNa2S2O3の物質量〔mol〕を求めてありますが、「半反応式は✬2e^-を放出する!」のに、何故物質量〔mol〕の計算では「✫1が乗じてある!」のでしょうか?
2e^-を放出するから、2e^-を乗じるのではないかと考える人もいるのではないでしょうか?私は最初そうでした。
これを半反応式で考えますと、通常ならば2e^-を乗じるのが定番です。では、何故そうならないのでしょうか?それは「✼ 係数に惑わされている!」為です!
2S2O3^2- → S4O6^2- + ✬2e^-
ここでは、2S2O3^2-の様に「✼ 係数が2!」となっています。この場合係数を考えますと、2〔mol〕のS2O3^2-から✬2e^-が放出されていますが、これはあくまでも形式上の事であって、実際には係数が1として考えて頂いた方が理解しやすいと思います!
重要視されるのは、「✼ チオ硫酸ナトリウムNa2S2O3の総物質量〔mol〕!」ですから、「✼ 係数を1として、1〔mol〕のNa2S2O3自体が電子1e^-を総物質量〔mol〕分だけ放出する!」と考えますと、「✼ 2を乗じるのではなくて、1を乗じる!」、という事になります!
少々ややこしいですが、「✼ 2S2O3^2-が2e^-を放出するのではなくて、実際には、S2O3^2-が電子1e^-を放出している!」と、大胆に考えて頂けたらと思います!
【✼ 第1段階酸化還元反応︰I2とH2Sの半反応式!】
I2 + 2e^- → 2I^- ー(1)
H2S → S + 2H^+ + 2e^- ー(2)
(1)+(2)より、両辺の2e^-を互いに消去すると、
I2 + H2S → 2I^- + S + 2H^+
【✼ 第2段階酸化還元反応︰I2とNa2S2O3の半反応式!】
I2 + 2e^- → 2I^- ー(1)
2S2O3^2- → S4O6^2- + 2e^- ー(3)
(1)+(3)より、両辺の2e^-を互いに消去すると、
I2 + 2S2O3^2- → 2I^- + S4O6^2-

上記画像より、(2)+(3)=(1)ですから、
2✕x〔mol〕+1✕0.10〔mol/L〕✕(20〔mL〕/1000〔mL/L〕)=2✕0.20〔mol/L〕✕(40〔mL〕/1000〔mL/L〕)
よって、硫化水素H2Sの物質量x〔mol〕は、
答.x=7.0✕10^-3〔mol〕
6.ヨードメトリー(ヨウ素還元滴定)の問題をイメージしながら解いていこう!

(1)求めるべきオゾンO3の物質量〔mol〕はヨウ化物イオン2I^-との比の関係を利用出来ます。比に必要なそれぞれの半反応式は、
還元剤︰2I^- → I2 + 2e^-
酸化剤︰O3 + 2H^+ + 2e^- → O2 + H2O
両辺の2e^-を互いに消去すると、
2I^- + O3 + 2H^+ → ✫I2 + O2 + H2O
これより、ヨウ化物イオン2I^-とオゾンO3の比は1︰1という事になります!
酸化剤︰O3 + 2H^+ + 2e^- → O2 + H2O
還元剤︰2I^- → I2 + 2e^-
ですが、この場合もヨージメトリーと同様にヨウ化物イオン2I^-の係数の2は考えずに、ヨウ化物イオンI^-自体が電子1e^-︰物質量〔mol〕2.0✕10^-4〔mol〕を放出すると、O3は2e^-を受け取れる。
つまり、O3は1e^-につき1.0✕10^-4〔mol〕受け取れ、2e^-では、
2✕1.0✕10^-4〔mol〕=2.0✕10^-4〔mol〕
の電子を受け取れる事になる為、結局比は、「1︰1」という事になります!
(2)(1)の酸化剤となった✫I2を、還元剤チオ硫酸ナトリウムNa2S2O3で滴定還元していきます。ここでも半反応式による比を利用して物質量比が求められます。
酸化剤︰I2 + 2e^- → 2I^-
還元剤︰2S2O3^2-(チオ硫酸イオン↔チオスルファト) → S4O6^2-(テトラチオン酸イオン) + 2e^-
両辺の2e^-を互いに消去し合うと、ヨウ化物イオン2I^-と「✼ テトラチオン酸ナトリウムNa2S4O6」が生成される事から、
I2 + 2S2O3^2- → 2I^- + S4O6^2-
これより、ヨウ素I2とチオ硫酸ナトリウムNa2S2O3の比は、1︰2という事になります!
(3)(1)の「2I^-︰O3=1︰1」と、(2)の「I2︰S2O3^2-=1︰2」より、I2はO3と同じ比である事から、求めるべきオゾンO3の物質量〔mol〕はNa2S2O3との比、
「O3︰S2O3^2-=1︰2」
で求める事が出来ます!
オゾンO3の物質量〔mol〕をxとしてNa2S2O3の物質量〔mol〕が、
0.010〔mol/L〕✕(20〔mL〕/1000〔mL/L〕)=2.0✕10^-4〔mol〕
である事からO3の物質量〔mol〕はNa2S2O3との比で求められる事から、
O3︰Na2S2O3=x︰0.010〔mol/L〕✕(20〔mL〕/1000〔mL/L〕)=x︰2.0✕10^-4〔mol〕=1︰2
より、
x=1.0✕10^-4〔mol〕
答.1.0✕10^-4〔mol〕
次に、O3のモル濃度〔mol/L〕は、
物質量〔mol〕÷体積〔L〕=モル濃度〔mol/L〕
より求める事が出来、O3の体積〔L〕が10〔mL〕である事から、
1.0✕10^-4〔mol〕÷(10〔mL〕/1000〔mL/L〕)=0.010〔mol/L〕
答.0.010〔mol/L〕
KI水溶液の総物質量〔mol〕︰0.10〔mol/L〕✕(100〔mL〕/1000〔mL/L〕)=1.0✕10^-2〔mol〕
より、画像中の(1’)で残存しているKIの物質量〔mol〕は、(1)の物質量︰2.0✕10^-4〔mol〕を差し引くと求められます!
1.0✕10^-2〔mol〕−2.0✕10^-4〔mol〕=9.8✕10^-3〔mol〕
【❋ まずは物質量〔mol〕を求める!】
事です!解っているようで見落としがちですので、今一度物質量〔mol〕の重要性を確認されたらと思います!
今回は、ヨウ素酸化滴定(ヨージメトリー)とヨウ素還元滴定(ヨードメトリー)について話を進めて参りましたが、冒頭の記述の様にCOD(化学的酸素要求量)より理解し易かったのではないでしょうか!
酸化還元反応による考え方は同じ様なイメージをして頂けたらOKです。ただ使用される物質が異なるだけであって、本来、何ら手法自体は変わらないと解釈して頂いて構わないと思います。
酸化還元反応は電子の動きを辿る最高の練習台になりますので、酸化剤と還元剤の電子のやり取りを存分にイメージして自分のモノにして下さい!
それではまた別の化学で会いましょう。See you!




















