前回はベンゼンC6H6からクロロベンゼンC6H5Clが生成する仕組みを紹介致しました。今回はベンゼンC6H6からニトロベンゼンC6H5NO2が生成する仕組みを紹介したいと思います。
ニトロ化としてニトロベンゼンC6H5NO2が生成する仕組みは、ハロゲン化としてクロロベンゼンC6H5Clが生成する仕組みと非常に似ていますので、スムーズに理解出来るはずです。
それでは最初にニトロベンゼンC6H5NO2が生成するまでに必要な知識をちょこっとだけインプットする事から始めて行きましょう。
1.硝酸HNO3内の結合はどうなってる?

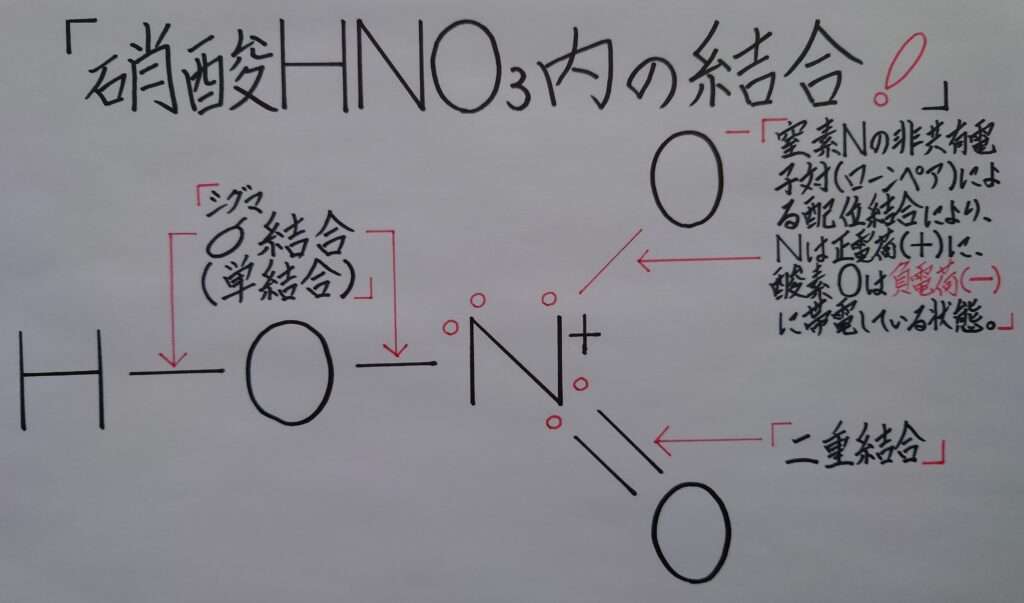
ここで注目すべき所が3つのN−O間内での配位結合と二重結合です。単純に考えると、両方共二重結合で良さそうです。ですが、本来窒素原子N内に1対の非共有電子対(ローンペア)と、3個の不対電子を電子として所有している事から、結合の仕方は別々に考えます。
つまり、窒素原子Nの非共有電子対を酸素原子Oの空軌道に配位結合として、2個の不対電子を二重結合に、残った不対電子1個をσ(シグマ)結合として結合に使われている事になります。微妙な結合名ですが、特に非共有電子対を意識して考えて頂きますと、結合の区別が理解しやすいのではないでしょうか。
また硝酸HNO3は水中で強酸として存在していますが、これは硝酸内の2つの酸素原子Oが窒素原子Nを電気陰性度の差によって引き付ける為に、窒素原子Nが正電荷(+)に偏る事と、Nがσ結合を形成している酸素原子Oを通常より引き寄せている事が起因していると思われます。
結果、最終的には酸素原子Oとσ結合を形成している水素原子Hの電子がむき出し状態となり、よりO側に引き付けられる為に水素原子Hが正電荷(+)に帯電します。すると、周りの水分子H2O内の酸素原子Oの非共有電子対によって、硝酸HNO3内の水素原子Hを水素イオンH^+として引き付け配位結合し、オキソニウムイオンH3O^+が生成する事により酸性を示すと考えられます!
さて硝酸内の結合と特性を踏まえて、いよいよここから段階的に強酸を示す硝酸HNO3が何故ニトロベンゼンC6H5NO2として生まれ変われるのかを定番であります、皆さんに各々自分なりのイメージをして頂き、一緒に考えて行く事に致しましょう!
2.濃硫酸H2SO4を不可欠な触媒として、求電子剤・ニトロニウムイオンNO2^+が生成される!
濃硝酸と濃硫酸の反応は濃硫酸の方がより強酸として優位に立つ為に、濃硫酸の放出した水素イオンH^+1個を濃硝酸が受け取る事になり、❝濃硝酸は一旦H2NO3^+として存在❞します!
【※ まず硝酸より強酸性の強い硫酸が放つ水素イオンH^+を硝酸HNO3内の酸素原子Oの非共有電子対に配位結合させる反応から始動します!】
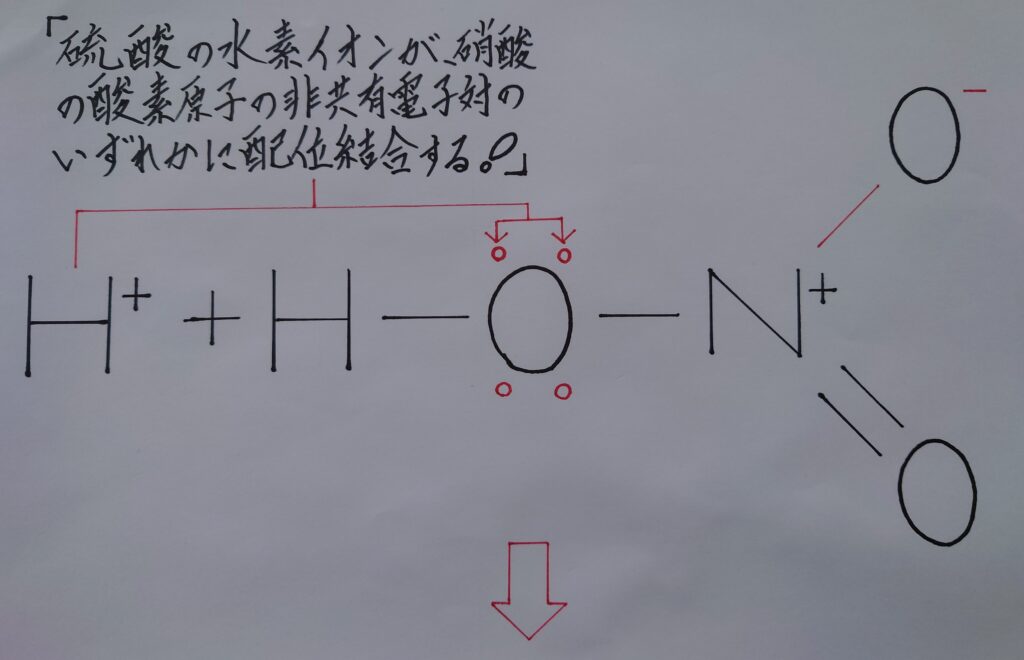
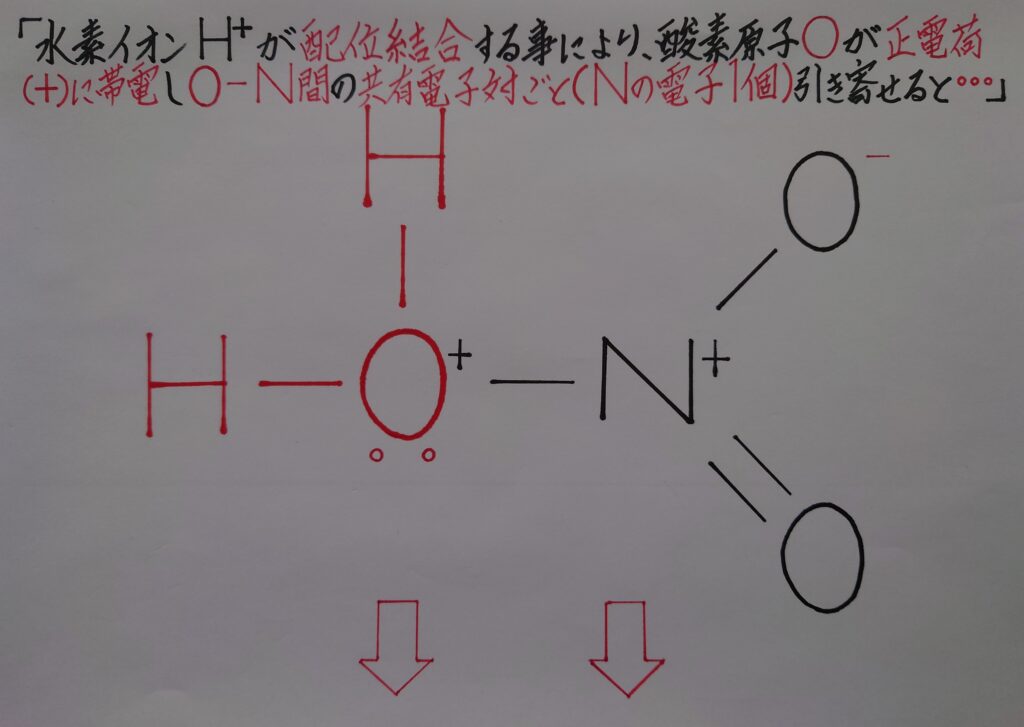
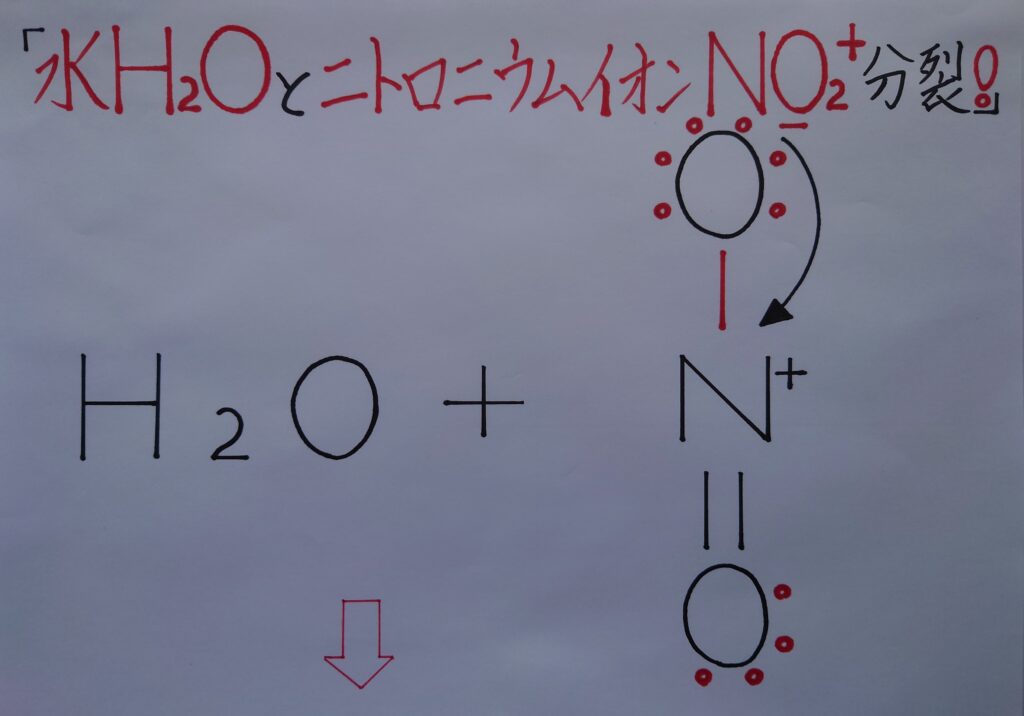

次に、H2NO3^+(H2O−NO2^+)内の水H2Oが最も安定した物質として優位に立つ為、H2O内の酸素原子Oが、酸素原子Oと窒素原子N間での電子を共有電子対ごと引き寄せ奪い(※ Nの所有する電子1個が完全にOの電子となる!)、この構造から水H2Oが脱水(※ 水H2Oとして脱離する事!)分離されます!
また同時にニトロニウムイオンNO2^+も分裂し生成されると、NO2^+内の正電荷(+)に帯電している窒素Nが上部の酸素原子Oの電子を1個引き寄せます。すると、ニトロニウムイオンNO2^+の内部で電子が1π電子として移動し、酸素原子Oとの間で二重結合であるπ(パイ)結合を形成し、完全なニトロニウムイオンNO2^+となります!
さて、触媒である濃硫酸H2SO4の水素イオンH^+と濃硝酸HNO3が反応し合う事で、ベンゼンC6H6のニトロ化に必要な求電子剤︰ニトロニウムイオンNO2^+が生成されました。ここからいよいよ最終段階であるベンゼンC6H6とニトロニウムイオンNO2^+とを反応させて❝※ ニトロベンゼンC6H5NO2❞を生成させて行きましょう!
3.芳香族求電子置換反応によるニトロベンゼンC6H5NO2の生成!
ここからベンゼンC6H6とニトロニウムイオンNO2^+が反応し合う訳ですが、当然の如くベンゼン環は6π電子雲によって負(−)に帯電している為に、正(+)に帯電しているニトロニウムイオンはベンゼン環へと引き寄せられます!
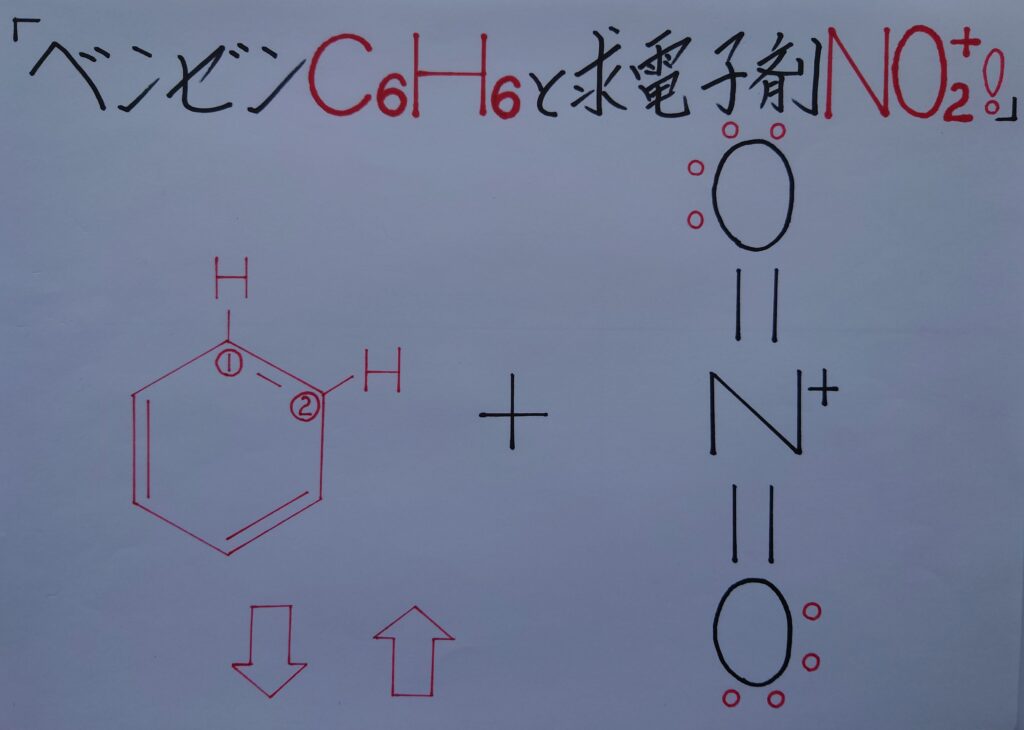
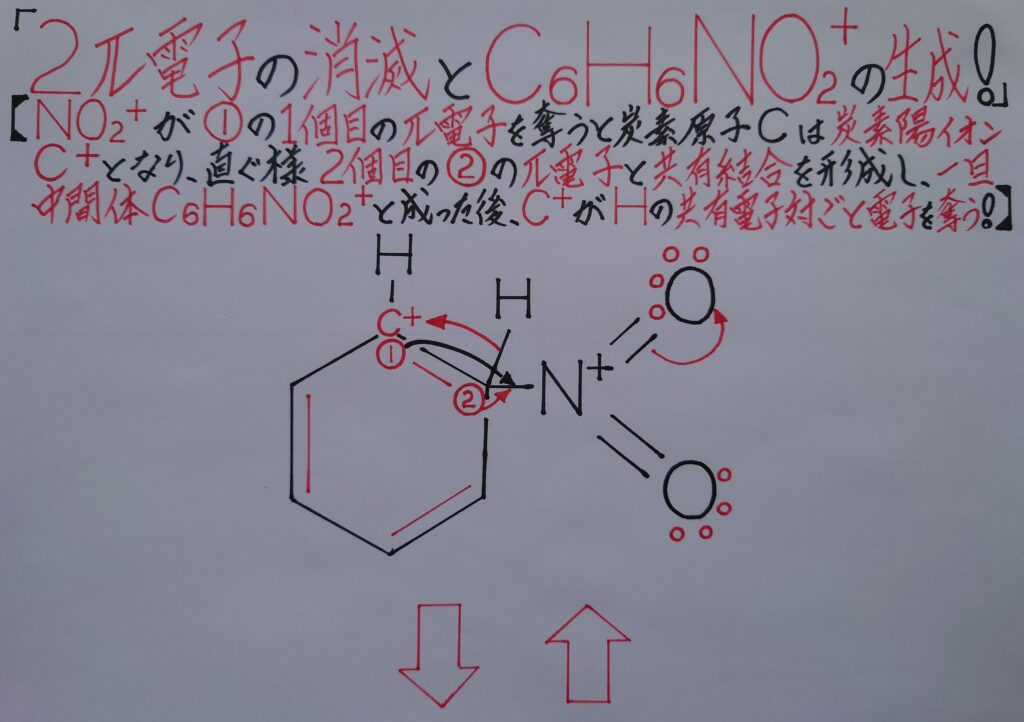
この時特に最重要なのが、「※ 窒素原子Nはオクテット則(8電子則)を完全に上回る為に、2つの酸素原子Oのいずれかの二重結合内のπ結合の2電子が完全に酸素原子O側に移動(※ ここでは、2番目と3番目画像中の右上の酸素原子Oになります!)し負(−)に帯電する事と、窒素原子Nのπ結合内の1π電子が酸素原子O側に奪われ移動した為にNは正(+)に帯電し、NとOは共にオクテット則を満たす!」という事です!
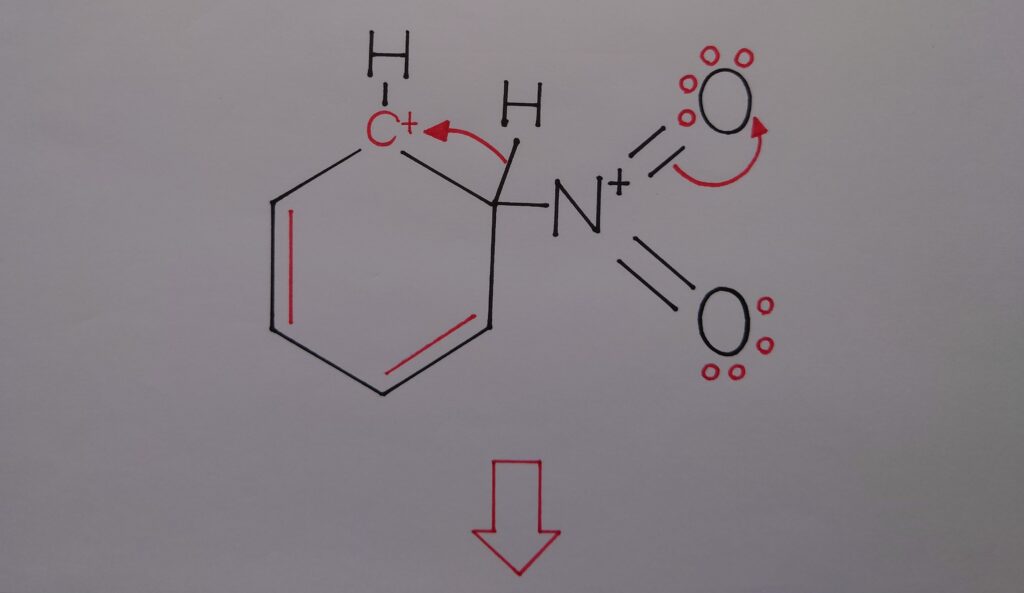
つまり窒素原子Nの所有する1π電子がいずれかの酸素原子Oに奪われ失い正(+)に帯電し二重結合からσ結合となる事によって、❝一旦中間体であるC6H6NO2^+を形成している状態!❞を表しています。この後、オルト位の水素原子Hが炭素原子Cとの共有電子対ごと炭素陽イオンC^+に引き寄せられます!
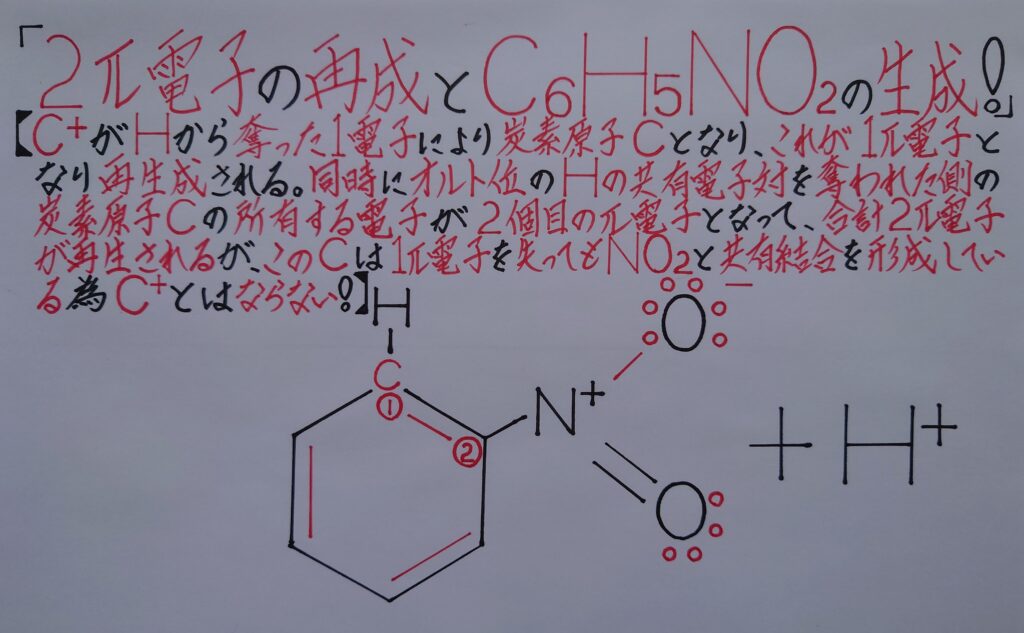
同時にオルト位の水素原子Hと共有結合を形成していた(2)の炭素原子Cは結合が断裂した為Cの電子が1個余る事になり、この余った電子が2個目のπ電子となって再生(※ 6π電子雲の再生!)されます(※ この炭素原子Cは、既に窒素原子Nとσ結合を形成しています!)!
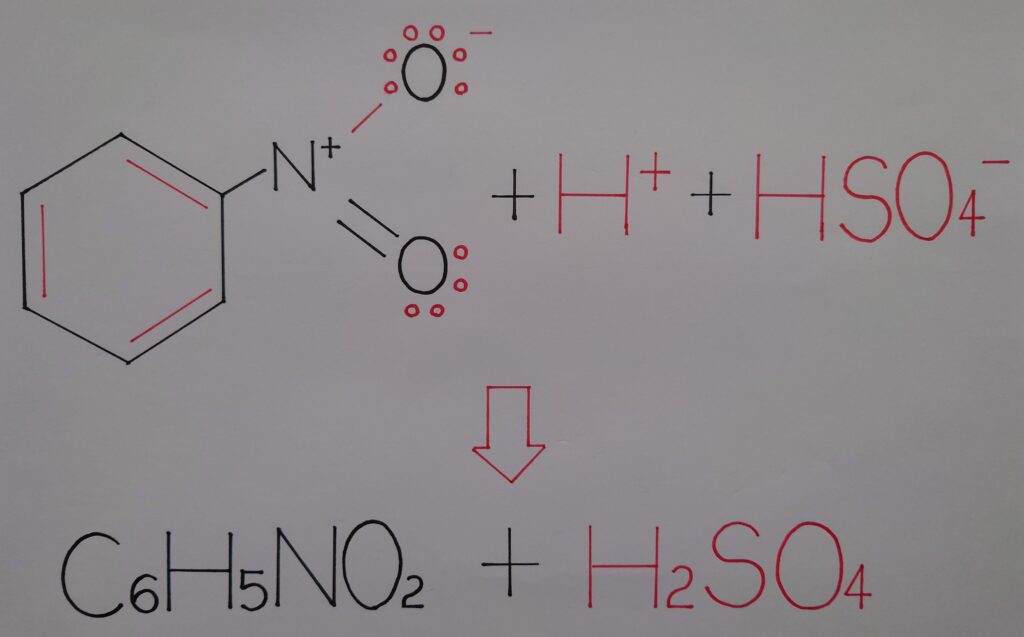
最終段階と致しまして、濃硫酸H2SO4が触媒であった事の証明を画像に致しました。この事から、ニトロベンゼンC6H5NO2が生成される為には、触媒として濃硫酸H2SO4が不可欠である事が理解出来たのではないでしょうか(※ C6H5NO2が電気的に中性を示しているのは、窒素原子Nが正(+)に、酸素原子Oが負(−)に帯電している事により互いに中和され、差し引きゼロ(O)となっている為です!)!
以上を、ベンゼンC6H6のH原子がニトロ基(−NO2)に置換されます、ベンゼンC6H6と、濃硝酸HNO3と濃硫酸H2SO4の混酸からニトロベンゼンC6H5NO2が生成する一連の流れの過程と致しましたが、皆さん各々自分なりのイメージをしっかりと創作出来たのではないでしょうか!
【✺ ニトロベンゼン同様に、クロロベンゼン・ベンゼンスルホン酸+クメン法も是非御覧下さい!】
「これぞ明解!ベンゼンから、クロロベンゼンが誕生する仕組み!」
「絶対太鼓判!ベンゼンからベンゼンスルホン酸が誕生する仕組み!」
「全集中フル回転!実はクメン法、凄い神技だらけの宝庫だった!」
4.原子間での電子の動きを完璧にマスターし理解しておこう!
以前も別記事にて記述致しましたが、❝化学は電子の移動が最重要!❞とされています。特に、芳香族求電子置換反応の様なベンゼン環の水素原子Hが、ある置換基に置き換わる反応等は、電子が原子間をどの様に移動しているかが非常に重要となって来ます。
また電子と言っても、共有結合している電子と非共有電子対(ローンペア)の電子は全く同じ電子ですが、原子間を移動する電子を追跡するとなると、少々理解に手こずる場面も少なくないのではないでしょうか?
芳香族求電子置換反応等は、皆さんが電子を追跡する場合にうってつけの教材だと思います。ですので電子の追跡に関しましては、1つ1つ確実に矢印で追跡しながら理解して頂けたら、また化学が更に好きになれるのではないでしょうか!
私事ではありますが、最初は特に「コレでもか!」って言う程電子の追跡に努めました。電子の動きが理解出来る様になると、新しい単元に踏み込んでも所詮は電子の移動が最重要と割り切ると、全く苦になりませんでした。皆さんも、是非電子の追跡を少しずつでもやって頂けたらと思います!
【✺ 電子には、混成軌道も付き物ですので、こちらの別記事も是非御覧下さいね!】
「必見!酢酸CH3COOHの2s軌道が電子0個になる謎とは!?」
さて次回は、ベンゼンのスルホン化について挑戦してみようかなと思っています。これからも皆さんが完璧に理解出来ます様に、記事に精進して参りますので何卒宜しくお願い致します!では皆さん、今回はこの辺でまた、See you !




















